题目内容
【题目】我国有广阔的海岸线,海水综合利用大有可为.海水中Br﹣含量为65mgL﹣1 , 从海水中提取溴的工业流程如下: 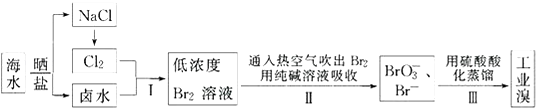
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是: .
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2 , 利用了溴的(填序号).
A.氧化性
B.还原性
C.挥发性
D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
Br2+CO32﹣═BrO3﹣+Br﹣+CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴蒸气与二氧化硫水溶液反应的离子方程式: .
(5)实验室从溴水中分离出溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是(填序号).
A.乙醇
B.四氯化碳
C.裂化汽油
D.苯
(6)用上述流程制得含Br265%的工业溴1t,至少需要海水m3 .
(7)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的离子方程式: .
【答案】
(1)富集溴元素
(2)C
(3)3;3;1;5;3
(4)SO2+Br2+2H2O=4H++2Br﹣+SO42﹣
(5)BD
(6)2.0×104
(7)SO2+Br2+2H2O=4H++2Br﹣+SO42﹣
【解析】解:(1)步骤Ⅰ中已获得游离态的溴浓度很低,如果直接蒸馏,生产成本较高,不利于工业生产,步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集溴元素,降低成本,所以答案是:富集溴元素;(2)溴易挥发,步骤Ⅱ通入热空气或水蒸气吹出Br2 , 就是利用溴的挥发性,故选C,所以答案是:C;(3)该反应中Br元素化合价由0价变为﹣1价、+5价,其最小公倍数是5,再结合原子守恒或电荷守恒得方程式为3Br2+3CO32﹣═BrO3﹣+5Br﹣+3CO2↑,所以答案是:3;3;1;5;3;(4)上述流程中吹出的溴蒸气,也可以用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.溴与二氧化硫水溶液反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4 , 离子方程式:SO2+Br2+2H2O=4H++2Br﹣+SO42﹣ , 所以答案是:SO2+Br2+2H2O=4H++2Br﹣+SO42﹣;(5)萃取剂的选取标准:萃取剂和溶质不反应、溶质在萃取剂中的溶解度大于在原溶剂中的溶解度、萃取剂和原溶剂不互溶,
A.乙醇易溶于水,所以不能作萃取剂,故A错误;
B.四氯化碳符合萃取剂选取标准,所以能作萃取剂,故B正确;
C.裂化汽油和溴能发生加成反应,所以不能作萃取剂,故C错误;
D.苯符合萃取剂选取标准,所以能作萃取剂,故D正确;所以答案是:BD;(6)用上述流程制得含Br265%的工业溴1t,含溴元素质量=1t×65%×2=1.3t=1.3×109mg,海水中Br﹣含量为65mgL﹣1 , 溴元素守恒,则海水的体积= ![]() =2.0×107L=2.0×104m3 , 所以答案是:2.0×104;(7)溴具有强氧化性、二氧化硫具有还原性,二者在水溶液中混合易发生氧化还原生成氢溴酸和硫酸,反应的离子方程式为:SO2+Br2+2H2O=4H++2Br﹣+SO42﹣ , 所以答案是:SO2+Br2+2H2O=4H++2Br﹣+SO42﹣ .
=2.0×107L=2.0×104m3 , 所以答案是:2.0×104;(7)溴具有强氧化性、二氧化硫具有还原性,二者在水溶液中混合易发生氧化还原生成氢溴酸和硫酸,反应的离子方程式为:SO2+Br2+2H2O=4H++2Br﹣+SO42﹣ , 所以答案是:SO2+Br2+2H2O=4H++2Br﹣+SO42﹣ .

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案