题目内容
6.锰及其化合物间的转化如图1.
请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:2MnO2+4KOH+O2 $\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.反应③发生的主要化学反应的方程式为:3Mn3O4+8Al $\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn.
(2)粗KMnO4晶体中含有少量的K2CO3,检验其中的少量CO32-用可溶性的钙盐或钡盐试剂;为了得到纯的KMnO4晶体,操作Ⅲ的名称为重结晶.
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀.当高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点.写出该反应的离子方程式:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13.工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=2.4×10-5mol/L.
(5)如图2,用Fe、C作电极电解含MnO4-的污水,使之转化为沉淀除去.A电极是Fe(填“Fe”或“C”),污水中MnO4-转化为沉淀除去的离子方程式为5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓.
分析 将MnO2和KOH粉碎混合,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体,重结晶得到纯KMnO4晶体,
(1)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数,根据钾元素守恒确定KOH系数,根据氢元素守恒确定H2O系数;反应③发生的主要化学反应是铝热反应,铝还原四氧化三锰得到金属锰;
(2)粗KMnO4晶体中含有少量的K2CO3,检验其中的少量CO32-用可溶性钡盐或钙盐检验;为了得到纯的KMnO4晶体,粗晶体可以采取重结晶的方法提纯;
(3)向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀二氧化锰,根据元素守恒和电荷守恒书写离子方程式;
(4)根据Ksp[Mn(OH)2]=c(Mn2+)•c2(OH-),可计算出c(Mn2-);
(5)用Fe、C作电极电解含MnO4-的污水,需要还原剂,电解池中铁做阳极失电子生成亚铁离子,亚铁离子还原高锰酸根离子生成锰离子,在碱溶液中生成氢氧化锰.
解答 解:(1)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,反应③发生的主要化学反应是铝热反应,铝还原四氧化三锰得到金属锰,反应的化学方程式为:3Mn3O4+8Al$\frac{\underline{\;高温\;}}{\;}$ 4Al2O3+9Mn,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;3Mn3O4+8Al$\frac{\underline{\;高温\;}}{\;}$ 4Al2O3+9Mn;
(2)粗KMnO4晶体中含有少量的K2CO3,检验其中的少量CO32-用可溶性的钙盐或钡盐,溶解后加入钡盐或钙盐生成白色沉淀,为了得到纯的KMnO4晶体,操作Ⅲ是粗晶体提纯,操作的名称为重结晶,
故答案为:可溶性的钙盐或钡盐均可;重结晶;
(3)向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀二氧化锰,反应的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+,
故答案为:2MnO4-+3Mn2++2H2O═5MnO2↓+4H+;
(4)当pH=10时,c2(OH-),c(OH-)=1×10-4 mol/L,根据Ksp[Mn(OH)2]=c(Mn2+)•c2(OH-),可知c(Mn2-)=$\frac{Ksp(Mn(OH)_{2})}{{c}^{2}(O{H}^{-})}$=$\frac{2.4×1{0}^{-13}}{(1×1{0}^{-4})^{2}}$=2.4×10-5mol/L,
故答案为:2.4×10-5mol/L;
(5)用Fe、C作电极电解含MnO4-的污水,需要还原剂,电解池中铁做阳极失电子生成亚铁离子,亚铁离子还原高锰酸根离子生成锰离子,在碱溶液中生成氢氧化锰,反应的离子方程式为:5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓,
故答案为:Fe; 5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力、电解池原理、溶度积常数计算等,题目难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

| A. | 容器内气体密度保持不变 | |
| B. | 容器内温度不再变化 | |
| C. | 断裂1mol N≡N键的同时,生成6mol N-H键 | |
| D. | 反应消耗N2、H2与产生NH3的速率之比1:3:2. |
| A. | 100 mL 0.1 mol•L-1 K2SO4溶液中,含有氧原子数为0.04NA | |
| B. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| C. | 25℃时,1.0 L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA | |
| D. | 100 g 17%的氨水中,含有氨分子数为NA |
| A. | CO2的电子式: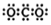 | |
| B. | CS2分子的结构式:S=C=S | |
| C. | S2-的结构示意图: | |
| D. | 8个中子的碳原子的核素符号:${\;}_6^{14}C$ |
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| C. | 1-丁烯(CH3CH2CH═CH2)与HCl分子发生的加成反应 | |
| D. | 苯甲酸( )与NaHCO3溶液反应 )与NaHCO3溶液反应 |

已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质.电池总反应为
2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式MnO2+H2O+e-=MnOOH+OH-;
(2)为了提高碳包的浸出效率,可以采取的措施有适当的升温或搅拌;(写一条即可)
(3)向滤液1中加入MnS的目的是将溶液中的Zn2+离子转化为ZnS沉淀而除去;
(4)已知MnSO4的溶解度曲线如图1所示,从滤液2中析出MnSO4•H2O晶体的操作是蒸发结晶、趁热过滤、洗涤、低温干燥;
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.4 |
| 2 | 铁粉 | 2.7 |
| 3 | FeS粉末 | 3.0 |
| 4 | 30%过氧化氢 | 3.7 |
(6)工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是碳酸钠溶液碱性强,容易产生Mn(OH)2沉淀;
(7)该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY.实验过程如下:准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500mol•L-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为25.2%.(保留3位有效数字)
| A. |  1,2-二甲苯 1,2-二甲苯 | B. | CH2=CH-CH=CH2 1,3-二丁烯 | ||
| C. |  2-丁醇 2-丁醇 | D. |  2-甲基丁烷 |
| A. | 在周期表中金属与非金属的分界处可以找到半导体材料 | |
| B. | H2S、HCl、HF的热稳定性依次减弱 | |
| C. | NaOH、KOH、Mg(OH)2的碱性依次减弱 | |
| D. | Cl、S、P元素的非金属性依次增强 |
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.