题目内容
某原子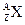 的氯化物XCl2 1.11g配成溶液后,需用1mol·L-1的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 1.11g配成溶液后,需用1mol·L-1的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数。
(2)若X的核内中子数为20,求22.2gXCl2中所含质子的物质的量是多少?
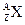 的氯化物XCl2 1.11g配成溶液后,需用1mol·L-1的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 1.11g配成溶液后,需用1mol·L-1的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:(1)X的质量数。
(2)若X的核内中子数为20,求22.2gXCl2中所含质子的物质的量是多少?
(1)40 (2)10.8mol。
根据题意,氯化物XCl21.11g配成溶液后,需用1mol·L-1的硝酸银溶液20mL才能把氯离子完全沉淀下来,可设XCl2的摩尔质量为N,由
XCl2 ~ 2AgNO3
1mol 2mol
1.11g/Ng·mol-1 1g·mol-1×0.02L
可得N=111g·mol-1,则A=40,Z=20,
22.2gXCl2中所含质子的物质的量为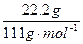 ×(20+17×2)=10.8mol。
×(20+17×2)=10.8mol。
XCl2 ~ 2AgNO3
1mol 2mol
1.11g/Ng·mol-1 1g·mol-1×0.02L
可得N=111g·mol-1,则A=40,Z=20,
22.2gXCl2中所含质子的物质的量为
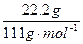 ×(20+17×2)=10.8mol。
×(20+17×2)=10.8mol。
练习册系列答案
相关题目
 B、
B、 B,硼元素的近似相对原子质量为10.80,则对硼元素中
B,硼元素的近似相对原子质量为10.80,则对硼元素中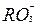 与R-发生如下反应
与R-发生如下反应 +5R-+6H+
+5R-+6H+ 3R2+3H2O,下列有关R元素的叙述正确的是( )
3R2+3H2O,下列有关R元素的叙述正确的是( )