题目内容
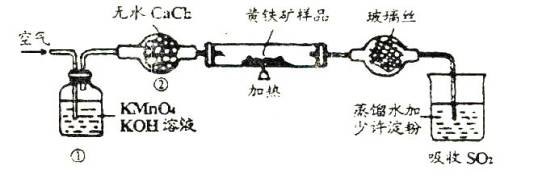
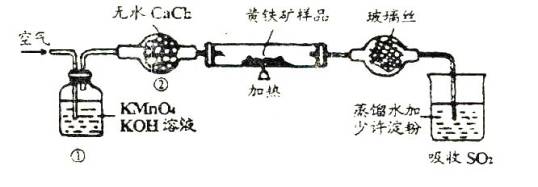
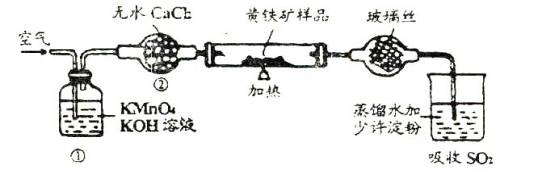
下面是一个实验室测定黄铁矿中硫的质量分数的装置.实验时有如下操作:
A. 将试管中的样品加热到800—850℃
B. 称取研细的黄铁矿样品
C. 连接全部仪器,使其成为整套试验装置,并检查气密性
D. 将样品小心放入容器中,在将容器小心地推入试管中部
E. 以每分钟1 L的速度鼓入空气
F. 用标准碘液滴定含淀粉的SO2水溶液
(1)正确的试验步骤,其操作编号是 。
(2)装置(1)的作用是 ;装置(2)的作用是 。
(3)碘液跟二氧化硫水溶液发生反应的化学方程式是 。
(4)假定矿样品的硫全部转化为二氧化硫,并全部被水吸收。若称得矿样的质量是0.12克,滴定管中最初读数为0.10mL,末读数为25.60mL,标准碘液的浓度为0.05摩/升,则黄铁矿样品种的含硫量是(列式及答案) 。
答案:
解析:
提示:
解析:
(1)C B D E A F (2)除去空气中的还原性气体,净化空气吸水蒸气,干燥空气。 (3)I2+SO2+2H2O=2HI+H2SO4
|
提示:
气体试验第一步总是检查装置的气密性。该实验室利用I2的氧化性将SO2氧化,自身被还原为I-,通过溶液变蓝且不褪色来指示I2与SO2正好反应,所以要排除空气中还原性气体的干扰,再利用I2—SO2—S (S守恒)可以计算出S元素质量。
|

练习册系列答案
相关题目