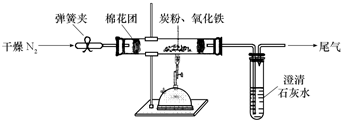
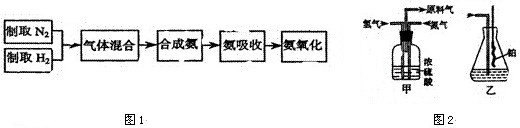
题目内容
亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2.酸性KMnO4溶液与亚硝酸钠发生的离子反应为MnO4-+NO2-+H+-→Mn2++NO3-+H2O(未配平),下列叙述错误的是
- A.生成1 mol Mn2+,转移电子为5 mol
- B.该反应中氮元素被氧化
- C.配平后,水的化学计量数为3
- D.反应中氧化产物与还原产物的物质的量之比为2:5
D
分析:氧化还原反应的本质是电子的转移.元素得电子,化合价降低,失去电子,化合价升高.氧化还原反应的配平,就是元素化合价上升的总和等于化合价降低的总和.该题应先将酸性KMnO4溶液与亚硝酸钠发生的离子反应配平后再解答.
解答:酸性KMnO4溶液与亚硝酸钠发生的反应中,MnO4-中的+7价的Mn变成Mn2+中+2价的Mn,1mol得到5mol电子,NO2-中的N从+3价变成NO3-中+5价的N,1mol失去2mol电子.根据氧化还原反应中元素化合价上升的总和等于元素化合价降低的总和.酸性KMnO4溶液与亚硝酸钠发生的离子反应为:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,
A.生成1 mol Mn2+,由MnO4-中的+7价的Mn变成Mn2+中+2价的Mn,转移电子为5 mol,故A正确;
B.该反应中氮元素 从NO2-中的N+3价变成NO3-中+5价的N,化合价升高,失去电子,被氧化,故B正确;
C.配平后,反应为:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,水的化学计量数为3,故C正确;
D.反应中氧化产物是指元素化合价升高后的产物,该题中NO2-中的N从+3价变成NO3-中+5价的N,NO3-是氧化产物,还原产物,是指元素化合价降低后的产物,该题中MnO4-中的+7价的Mn变成Mn2+中+2价的Mn,Mn2+是还原产物.根据反应方程式,反应中氧化产物与还原产物的物质的量之比为5:2,故D错误;
故选D.
点评:本题为氧化还原反应题,需正确理解氧化还原配平的原理,掌握电子转移的数目和化合价的关系,掌握氧化产物为被氧化后的产物,是元素化合价升高后的产物等相关重要知识点,是解题的关键.
分析:氧化还原反应的本质是电子的转移.元素得电子,化合价降低,失去电子,化合价升高.氧化还原反应的配平,就是元素化合价上升的总和等于化合价降低的总和.该题应先将酸性KMnO4溶液与亚硝酸钠发生的离子反应配平后再解答.
解答:酸性KMnO4溶液与亚硝酸钠发生的反应中,MnO4-中的+7价的Mn变成Mn2+中+2价的Mn,1mol得到5mol电子,NO2-中的N从+3价变成NO3-中+5价的N,1mol失去2mol电子.根据氧化还原反应中元素化合价上升的总和等于元素化合价降低的总和.酸性KMnO4溶液与亚硝酸钠发生的离子反应为:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,
A.生成1 mol Mn2+,由MnO4-中的+7价的Mn变成Mn2+中+2价的Mn,转移电子为5 mol,故A正确;
B.该反应中氮元素 从NO2-中的N+3价变成NO3-中+5价的N,化合价升高,失去电子,被氧化,故B正确;
C.配平后,反应为:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,水的化学计量数为3,故C正确;
D.反应中氧化产物是指元素化合价升高后的产物,该题中NO2-中的N从+3价变成NO3-中+5价的N,NO3-是氧化产物,还原产物,是指元素化合价降低后的产物,该题中MnO4-中的+7价的Mn变成Mn2+中+2价的Mn,Mn2+是还原产物.根据反应方程式,反应中氧化产物与还原产物的物质的量之比为5:2,故D错误;
故选D.
点评:本题为氧化还原反应题,需正确理解氧化还原配平的原理,掌握电子转移的数目和化合价的关系,掌握氧化产物为被氧化后的产物,是元素化合价升高后的产物等相关重要知识点,是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目