题目内容
Ⅰ.用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为:
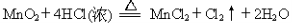
(1)该盐酸的物质的量浓度为 mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目 。
(3)8.7gMnO2能使 molHCl被氧化。
Ⅱ.在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原
的硫酸为 0.9 mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________________________________________________。
Ⅰ(1)11.9
(2)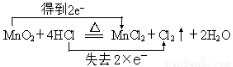
(3)0.2
Ⅱ 大于 3Cu+8H++2NO3-=3Cu2++2NO +4H2O
【解析】
试题分析:Ⅰ.(1)有公式c=1000pw/M=1000×1.19×36.5%/36.5=11.9 mol/L;
(2)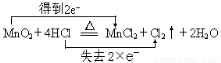
(3)在反应中MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1mol MnO2氧化2mol浓盐酸,所以8.7gMnO2能使0.2molHCl被氧化.
Ⅱ.已知反应 Cu+2H2SO4 CuSO4+2H2O+SO2 ↑硫酸有一半被还原 所以硫酸总物质的量为2×0.9=1.8(mol)
CuSO4+2H2O+SO2 ↑硫酸有一半被还原 所以硫酸总物质的量为2×0.9=1.8(mol)
又知,硫酸的物质的量浓度为18mol/L ;所以原体积为1.8/18=0.1L;参加反应H2SO4为0.9mol×2=1.8mol,体积100mL,因反应后稀H2SO4不与Cu反应,故H2SO4体积应大于100mL。加入硝酸盐后,相当于铜与稀硝酸反应,3Cu+8H++2NO3-=3Cu2++2NO +4H2O
考点:实验室制取氯气的反应,及铜与浓硫酸的反应

工业生产中常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。这是制取合金的常用方法之一。根据下表数据判断,不宜用上述方法制取合金的是( )
金属 | Na | Al | Cu | Fe |
熔点(℃) | 97.81 | 660 | 1 083 | 1 535 |
沸点(℃) | 883 | 2 200 | 2 595 | 3 000 |
A.Fe-Cu合金 B.Cu-Al合金
C.Al-Na合金 D.Cu-Na合金