题目内容
【题目】实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
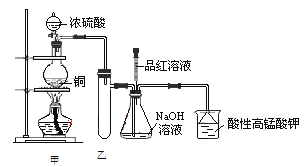
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4是否剩余________,原因是_____________ 。
①下列药品中,能够证明反应后烧瓶中有硫酸剩余的是________
A.Fe粉 B.BaCl2溶液 C.Ag D. 饱和NaHSO3溶液
②当向甲中反应后的溶液中通入氧气,发现铜片全部溶解,且仅生成硫酸铜溶液,则该反应的离子方程式为________________
(2)装置乙的作用是________________。
(3)请写出铜与浓硫酸反应的化学方程式___________________,浓硫酸在此反应中体现了_____________性质。
(4)下列说法正确的是________(填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
【答案】 剩余 随着反应进行,H2SO4越来越稀,稀H2SO4与Cu不反应,所以H2SO4一定有剩余 A D 2Cu +O2 +4H+═2Cu2+2H2O 防止NaOH溶液倒吸入甲中 Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑ 酸性和强氧化性 bd
CuSO4+2H2O+SO2↑ 酸性和强氧化性 bd
【解析】本题考查物质的制备实验,(1)铜过量,铜只与浓硫酸反应,随着反应的进行,硫酸的浓度降低,某一时刻,反应停止,容器中有硫酸剩余;①A、加入铁粉有气体生成,可以证明有硫酸剩余;B、铜与浓硫酸反应生成Cu(SO4)2,加入BaCl2产生白色沉淀,不能说明有硫酸剩余,故错误;C、加入Ag,Ag不与硫酸反应,不能说明有硫酸剩余,故错误;D、加入NaHSO3,2NaHSO3+H2SO4=Na2SO4+2H2O+2SO2↑,说明有硫酸剩余,故正确;②反应物是Cu、氧气、硫酸,产物是CuSO4和H2O,因此反应方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O,离子反应式为2Cu+O2+4H+=2Cu2++2H2O;(2)SO2是酸性气体,与NaOH反应,容易倒吸,因此装置乙的作用是防止NaOH溶液倒吸入甲中,或作安全瓶;(3)铜和浓硫酸反应方程式为:Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑;根据反应方程式,H2SO4中S的化合价降低,因此硫酸作氧化剂,反应后有SO42-,说明硫酸起酸性;(4)a、根据实验装置,装置甲中含有的玻璃仪器是分液漏斗、圆底烧瓶、酒精灯、导管,故错误;b、尾气是SO2,SO2以还原性为主,能使酸性高锰酸钾褪色,不产生有害气体,故正确;c、当把品红溶液滴入锥形瓶中,溶液中如果溶有SO2,,则品红褪色,若无SO2,则不褪色,但并不能说明无NaHSO3,故错误;d、没有SO2则品红溶液不褪色,因此品红溶液褪色,说明有SO2,过量的SO2与NaOH反应转成NaHSO3,故正确;e、SO2、Na2SO3、NaHSO3都能使高锰酸钾溶液褪色,因此无法说明NaOH全部转化成NaHSO3,故错误;
CuSO4+2H2O+SO2↑;根据反应方程式,H2SO4中S的化合价降低,因此硫酸作氧化剂,反应后有SO42-,说明硫酸起酸性;(4)a、根据实验装置,装置甲中含有的玻璃仪器是分液漏斗、圆底烧瓶、酒精灯、导管,故错误;b、尾气是SO2,SO2以还原性为主,能使酸性高锰酸钾褪色,不产生有害气体,故正确;c、当把品红溶液滴入锥形瓶中,溶液中如果溶有SO2,,则品红褪色,若无SO2,则不褪色,但并不能说明无NaHSO3,故错误;d、没有SO2则品红溶液不褪色,因此品红溶液褪色,说明有SO2,过量的SO2与NaOH反应转成NaHSO3,故正确;e、SO2、Na2SO3、NaHSO3都能使高锰酸钾溶液褪色,因此无法说明NaOH全部转化成NaHSO3,故错误;
