题目内容
(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) |
|
|
|
|
|
|
|
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) |
|
|
|
|
|
|
|
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(4分) (1)离子方程式可表示为__ Zn2++4OH-===[Zn(OH)4]2-。
(2) Ksp=__10-17_。(3) pH的范围是__8.0<pH<12.0。
(4)正确的是_ A、B、C、D。
解析:

练习册系列答案
相关题目
回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如图所示.
根据上图所示步骤并参考表格数据,回答下列问题.
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.MnO2与浓盐酸反应的离子方程式: .
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是 .

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是 .
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是 .
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为 .
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为 .
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 .

根据上图所示步骤并参考表格数据,回答下列问题.
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为
 立方烷、棱晶烷和盆烯是近年来运用有机合成方法制备的具有如下图所示立体结构的环状有机物,对上述有机物的说法正确的是:( )
立方烷、棱晶烷和盆烯是近年来运用有机合成方法制备的具有如下图所示立体结构的环状有机物,对上述有机物的说法正确的是:( )| A、立方烷、棱晶烷和盆烯都不能使溴水褪色 | B、棱晶烷和苯互为同分异构体 | C、立方烷的二氯代物共有2种 | D、立方烷、棱晶烷中C原子都形成4个单键,因此它们都属于烷烃 |


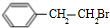 +KOH
+KOH +KBr+H2O
+KBr+H2O +
+
 +H2O
+H2O 、
、
 结构,且苯环上含有两个取代基的有
结构,且苯环上含有两个取代基的有