题目内容
(2012?深圳二模)苯乙烷(  -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯( -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是:
 -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol
-CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol  -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表: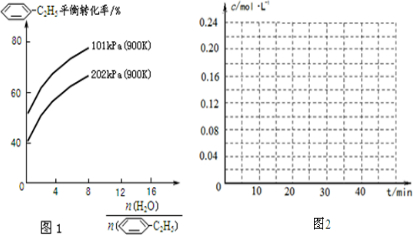
(1)n1=
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应). -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将
(3)副产物H2用做氢氧燃料电池.写出酸性条件下,该电池正极的电极反应式
(4)在相同条件下,若最初向该容器中充入 -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下  -C2H5(g)和
-C2H5(g)和 -CH=CH2(g)的浓度c随时间t变化的曲线
-CH=CH2(g)的浓度c随时间t变化的曲线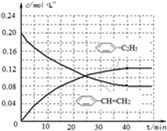
 .
.
 -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯( -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是: -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol
-CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol  -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
n( -C2H5)/mol -C2H5)/mol |
0.40 | 0.30 | 0.26 | n2 | n3 |
n( -CH=CH2)/mol -CH=CH2)/mol |
0.00 | 0.10 | n1 | 0.16 | 0.16 |
0.14
0.14
mol,计算该反应的平衡常数,K=0.053mol?L-1
0.053mol?L-1
.(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应).
 -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大
越大
(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
.(3)副产物H2用做氢氧燃料电池.写出酸性条件下,该电池正极的电极反应式
O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
.(4)在相同条件下,若最初向该容器中充入
 -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下  -C2H5(g)和
-C2H5(g)和 -CH=CH2(g)的浓度c随时间t变化的曲线
-CH=CH2(g)的浓度c随时间t变化的曲线

分析:(1)根据 -C2H5物质的量的变化计算反应速率,根据平衡时各物质的浓度计算平衡常数;
-C2H5物质的量的变化计算反应速率,根据平衡时各物质的浓度计算平衡常数;
(2)根据分压对平衡移动的影响分析;
(3)酸性氢氧燃料电池中,正极发生还原反应;
(4)苯乙烯曲线变化趋势在减小,弓向时间轴,且起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12).
 -C2H5物质的量的变化计算反应速率,根据平衡时各物质的浓度计算平衡常数;
-C2H5物质的量的变化计算反应速率,根据平衡时各物质的浓度计算平衡常数;(2)根据分压对平衡移动的影响分析;
(3)酸性氢氧燃料电池中,正极发生还原反应;
(4)苯乙烯曲线变化趋势在减小,弓向时间轴,且起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12).
解答:解:(1)20min时, -C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,
-C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,
根据方程式 -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g)可知,
-CH=CH2(g)+H2(g)可知,
生成 -CH=CH20.14mol,
-CH=CH20.14mol,
 -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g)
-CH=CH2(g)+H2(g)
起始:0.40mol 0 0
转化:0.16mol 0.16mol 0.16mol
平衡:0.24mol 0.16mol 0.16mol
平衡时:c( -C2H5)=0.12mol/L,c(
-C2H5)=0.12mol/L,c( -CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
k=
=0.053 mol?L-1,
故答案为:0.14; 0.053 mol?L-1;
(2)由化学方程式可知,增大压强,平衡向逆反应方向移动,则体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动,所以转化率增大,
故答案为:大;体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
(3)酸性氢氧燃料电池中,正极上氧气得电子发生还原反应,反应的电极方程式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
(4)在相同条件下,若最初向该容器中充入 -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c(
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c( -C2H5)=0.12mol/L,c(
-C2H5)=0.12mol/L,c( -CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图象为
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图象为 ,故答案为:
,故答案为: .
.
 -C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,
-C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,根据方程式
 -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g)可知,
-CH=CH2(g)+H2(g)可知,生成
 -CH=CH20.14mol,
-CH=CH20.14mol, -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g)
-CH=CH2(g)+H2(g)起始:0.40mol 0 0
转化:0.16mol 0.16mol 0.16mol
平衡:0.24mol 0.16mol 0.16mol
平衡时:c(
 -C2H5)=0.12mol/L,c(
-C2H5)=0.12mol/L,c( -CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,k=
| 0.08mol/L×0.08mol/L |
| 0.12mol/L |
故答案为:0.14; 0.053 mol?L-1;
(2)由化学方程式可知,增大压强,平衡向逆反应方向移动,则体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动,所以转化率增大,
故答案为:大;体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
(3)酸性氢氧燃料电池中,正极上氧气得电子发生还原反应,反应的电极方程式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
(4)在相同条件下,若最初向该容器中充入
 -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c(
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c( -C2H5)=0.12mol/L,c(
-C2H5)=0.12mol/L,c( -CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图象为
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图象为 ,故答案为:
,故答案为: .
.点评:本题考查化学平衡问题,题目难度中等,本题易错点为(2),注意水蒸气产生的分压对化学平衡的影响.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目