题目内容
工业常用高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4
| ||
为检验FeSO4高温分解的产物,进行如下实验:
(1)取少量分解后的固体加入稀盐酸溶解,为了检验溶液中是否有Fe3+,还需要向溶液中加入
(2)将分解产生的气体通入下图所示的装置中:
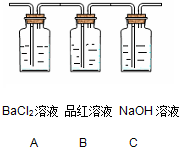
请回答下列问题:
如在装置
如在装置
(3)装置中的NaOH溶液的作用是
请写出相应反应的离子方程式
分析:(1)根据反应Fe3++3SCN-=Fe(SCN)3,生成的溶液变成红色进行检验铁离子;
(2)A中三氧化硫溶于水生成硫酸,与氯化钡溶液反应生成硫酸钡沉淀检验三氧化硫;利用二氧化硫能够使品红褪色检验二氧化硫;
(3)多余的二氧化硫会污染大气,需要使用尾气吸收装置,装置C中的氢氧化钠溶液用于吸收二氧化硫.
(2)A中三氧化硫溶于水生成硫酸,与氯化钡溶液反应生成硫酸钡沉淀检验三氧化硫;利用二氧化硫能够使品红褪色检验二氧化硫;
(3)多余的二氧化硫会污染大气,需要使用尾气吸收装置,装置C中的氢氧化钠溶液用于吸收二氧化硫.
解答:解:(1)检验铁离子,通常使用硫氰化钾溶液,为了检验溶液中是否有Fe3+,还需要向溶液中加入硫氰化钾溶液,如果溶液变红色,证明存在铁离子,
故答案为:硫氰化钾;溶液变红色;
(2)若装置A中的氯化钡溶液生成白色沉淀,证明分解产物中有三氧化硫;若装置B中品红溶液褪色,证明分解产物中含有二氧化硫,
故答案为:A;白色沉淀;B;品红溶液褪色;
(3)用于二氧化硫会污染大气,需要使用尾气吸收装置,氢氧化钠溶液能够与二氧化硫反应,可以除去多余的二氧化硫,反应的离子方程式为:2OH-+SO2=H2O+SO32-,
故答案为:除去多余的SO2,防止污染空气;2OH-+SO2=H2O+SO32-.
故答案为:硫氰化钾;溶液变红色;
(2)若装置A中的氯化钡溶液生成白色沉淀,证明分解产物中有三氧化硫;若装置B中品红溶液褪色,证明分解产物中含有二氧化硫,
故答案为:A;白色沉淀;B;品红溶液褪色;
(3)用于二氧化硫会污染大气,需要使用尾气吸收装置,氢氧化钠溶液能够与二氧化硫反应,可以除去多余的二氧化硫,反应的离子方程式为:2OH-+SO2=H2O+SO32-,
故答案为:除去多余的SO2,防止污染空气;2OH-+SO2=H2O+SO32-.
点评:本题考查了铁离子检验、常见气体的检验等知识,题目难度不大,注重质了灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严禁的规范实验能力.

练习册系列答案
相关题目
 Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。
Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。 

