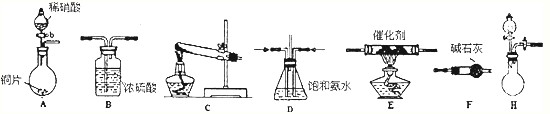
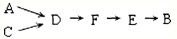题目内容
某同学为了验证温度对反应速率的影响情况,做了下列实验:反应方程式:2A(g)+B(g)=3C(g),下表是测 得的反应物A在某时刻的浓度。

试回答下列问题:
(1) 800℃时,0~10s内的平均反应速率为____,10s~20s内的平均反应速率为____,导致两个时间段内平均反应速率区别的原因是:____。
(2)850℃时,0~10s内的平均反应速率为___。
(3)对照800℃和850℃时,0~10s内的平均反应速率得知,温度对化学反应速率的影响情况为:____。
(1) 800℃时,0~10s内的平均反应速率为____,10s~20s内的平均反应速率为____,导致两个时间段内平均反应速率区别的原因是:____。
(2)850℃时,0~10s内的平均反应速率为___。
(3)对照800℃和850℃时,0~10s内的平均反应速率得知,温度对化学反应速率的影响情况为:____。
(1)0. 02mol·L-1·s-1 ;0.013mol·L-1·s-1 ;随着反应的进行,反应物的浓度逐渐减小,反应速率减慢
(2)0.06mol·L-1·s-1
(3)升高温度,反应速率加快
(2)0.06mol·L-1·s-1
(3)升高温度,反应速率加快

练习册系列答案
相关题目

 2CO2+N2
2CO2+N2