��Ŀ����
����Ŀ��ij����С���������ͼ��ʾ��ʵ��װ�ã�ͼ�й̶�װ������ȥ��������SO2���ʵ��о���
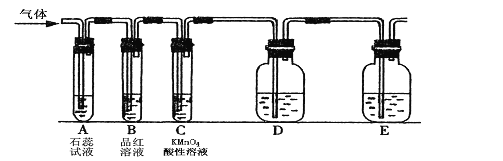
��1�������ʷ���ĽǶȣ�SO2����________������ԡ����ԡ��������д�������������γɵķ�Ӧ����ʽ�� _______ ��_____ ��
��2��ͼ��Dװ�ÿ�������֤SO2���и����ʣ�������������Լ��� _____��
��3�������װ��ͨ��SO2ʱ��A����ɫʯ����Һ��죬�û�ѧ���������ԭ���� ______ ��
��4����Ԫ�ػ��ϼ۵ĽǶȷ�����SO2�����ʡ�
�ٵ����װ��ͨ��SO2һ��ʱ��ɹ۲�C����Һ��ɫ��MnO4-ת��ΪMn2+,˵��SO2��
��______�ԣ���Ӧ�����ӷ���ʽΪ _________��
������֤SO2��������һ��������ʣ���ѡ���ҩƷ��__________��
A���������� B��Ũ���� C����ˮ D��������Һ
���𰸡� ���� SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 �μӷ�̪��NaOHϡ��Һ SO2+H2O=H2SO3 ��ԭ 5SO2 + 2MnO4 -+ 2H2O = 5SO4 2-+ 2Mn2+ + 4H + D
��������SO2����������������������������ͨ�ԣ�����SO2�����������ԡ���ԭ�Ժ�Ư���ԣ��ݴ˷������
��1����������ͼӦֻ�����κ�ˮ������Ϊ������������������ˮ��Ӧ���������ᣬ�������ױ�����Ϊ����Ӷ��γ����꣬��Ӧ�ķ���ʽΪSO2+H2O��H2SO3��2H2SO3+O2��2H2SO4����2��Ҫ��֤�������������������������ͼӦ�����������ƣ�����������������Ʒ�Ӧ�����������ƣ�����������Һ������������Һ������ɫ��Һ�����Է�Ӧ�������ԣ���������Һ�м����̪��Һ�����������Ƶ����ɣ���D��ʢ�ŵ�Һ���ǵμӷ�̪����������ϡ��Һ����3�����������ˮ��Ӧ���������ᣬ�������ܵ���������Ӷ�ʹ����Һ�����ԣ���ɫʯ����Һ������ɫ��������ɫʯ����Һ���ɫ���䷴Ӧ����ʽΪSO2+H2O��H2SO3����4�������Ը�����ؾ���ǿ�����ԣ����������������������ᣬ�÷�Ӧ�ж�����������ԭ�������Զ���������л�ԭ�ԣ���Ӧ����ʽΪ 5SO2 + 2MnO4 -+ 2H2O��5SO4 2-+ 2Mn2+ + 4H+����Ҫ֤����������������ԣ������������ͻ�ԭ�����ʷ���������ԭ��Ӧ��A������������������ԣ���������������A����B��Ũ�������ǿ�����ԣ��ҺͶ�������Ӧ��B����C����ˮ����ǿ�����ԣ���������������C����D�����ƾ��л�ԭ�ԣ��ܱ���������������D��ȷ����ѡD��

����Ŀ�����з�Ӧ��Na2S2O3+H2SO4=Na2SO4+SO2+S��+H2O�����и���ʵ�������ȳ��ֻ��ǵ� �� ��
ʵ�� | ��Ӧ�¶�/�� | Na2S2O3��Һ | ϡH2SO4 | H2O | ||
V/mL | c/��molL��1�� | V/mL | c/��molL��1�� | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
