题目内容
我国“蛟龙”号载人潜水器进行第五次下潜试验,最大深度达到7062米,并安全返同。其动力电源是Al-Ag2O电池,原理如图所示。下列说法中正确的是
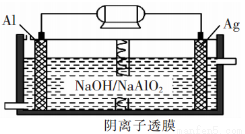
A.Al电极是该电池的正极
B.Ag在Ag2O/Ag电极上发生氧化反应
C.该电池负极反应是 2A1-6e-+8OH-=2AlO2-+4H2O
D.Ag2O/Ag电极附近溶液中的pH减小
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
(1)已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O (l) ΔH2
③H2O (l)= H2O (g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g) CO2(g)+2H2(g)的ΔH =________。
CO2(g)+2H2(g)的ΔH =________。
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0
CH3OH(g)+H2O(g)ΔH<0
①工业生产过程中CO2和H2的转化率________(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是_______________(填两点)。
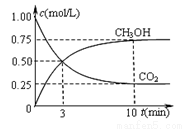
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如下图所示。该温度下的平衡常数为______(保留三位有效数字)。
改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)___K(Ⅱ)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(Ⅰ)___c(Ⅱ)。
②对反应Ⅰ,前10 min内的平均反应速率υ(CH3OH)=______,若30 min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,Zn(OH)2能溶于NaOH溶液。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)实验中的过滤操作所用到的玻璃仪器为____________________。
(2)加入ZnO调节pH=a的目的是____________________,a的范围是___________。
(3)由不溶物E生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是___________,__________,过滤。
(5)若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)若废旧黄铜的质量为a g,最终得到的胆矾晶体为b g,则该黄铜中铜元素的质量分数为_____________。


 N2H5+ + OH- I N2H5+ +H2O
N2H5+ + OH- I N2H5+ +H2O 
 N2(g)+2H2O(g)
N2(g)+2H2O(g) 变大的是_______。
变大的是_______。 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变