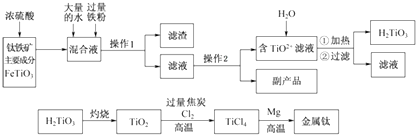
题目内容
【题目】过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验.
测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度.
实验原理2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
实验装置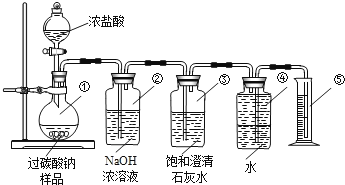
交流与讨论
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度.
(1)装置②的作用是:;
(2)装置③的作用是:;
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于g;
(4)Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度.但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是();(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
(5)Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7g.则该样品的纯度为多少?
【答案】
(1)除去二氧化碳和氯化氢气体
(2)验证二氧化碳是否被除尽
(3)2.44
(4)A,B,C
(5)
2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
244 234
y 11.7g
244:y=234:11.7,y=12.2g
该样品的纯度为: ![]() ×100%=97.6%
×100%=97.6%
【解析】解:Ⅰ.(1)装置②中浓氢氧化钠的作用是除去二氧化碳和氯化氢气体;(2)装置③中澄清石灰水的作用是验证二氧化碳是否被除尽;(3)设收集到的氧气的体积为0.25L,需要过碳酸钠的质量为x,
2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
244 32
x 0.25L×1.28g/L
244:x=32:(0.25L×1.28g/L)
Ⅱ.测得二氧化碳的体积偏大,原因可能有:浓盐酸易挥发,产生的氯化氢气体被装置②吸收;二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收;装置①、②内空气中的二氧化碳被装置②吸收;
Ⅲ.设样品中过碳酸钠的质量为y,根据2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O可求得Na2CO4的质量为12.2g,进而求出纯度。
【考点精析】利用酸碱中和滴定对题目进行判断即可得到答案,需要熟知中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

【题目】下列实验操作或事实与预期实验目的或所得结论对应错误的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有Fe3+ |
B | CaO | 实验室用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中可能含有H2SO3 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于二元酸 |
A. A B. B C. C D. D