题目内容
离子化合物A2B3是由短周期元素A和B形成,已知A3+离子比B2-离子少一个电子层,以下推断正确的是
| A.化合物A2B3是氧化铝 |
| B.A3+和B2-最外电子层上的电子数都是8 |
| C.A的最高价氧化物对应的水化物是强电解质 |
| D.元素B是第2周期第VIA族的元素 |
B
试题分析:由两种短周期元素A和M形成的离子化合物A2M3,A3+离子比M2-离子少一个电子层,则A和M都属于第三周期,且A3+具有与Ne原子相同的核外电子层结构,则A是Al元素,M是S元素,A.根据以上分析知化合物A2M3是Al2S3,故A错误;B.铝离子的结构示意图为
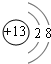 ,硫离子的结构示意图为
,硫离子的结构示意图为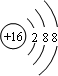 ,故B正确;C.A的最高价氧化物的水化物是Al(OH)3,氢氧化铝是弱电解质,故C错误;D.M是S元素,其原子结构示意图为
,故B正确;C.A的最高价氧化物的水化物是Al(OH)3,氢氧化铝是弱电解质,故C错误;D.M是S元素,其原子结构示意图为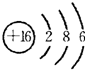 ,电子层数等于其周期数,最外层电子数等于与其族序数相等,所以S元素位于第三周期第VIA族,故D错误;故选B。
,电子层数等于其周期数,最外层电子数等于与其族序数相等,所以S元素位于第三周期第VIA族,故D错误;故选B。
练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目

 O和
O和 O中子数相同,质子数不同,互为同位素
O中子数相同,质子数不同,互为同位素 价。
价。 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;  ,其基态原子的价电子层电子排布式正确的是
,其基态原子的价电子层电子排布式正确的是