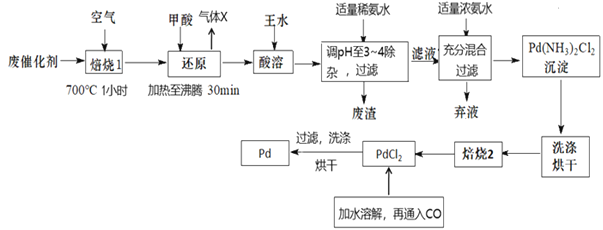
题目内容
【题目】(1)已知AX3的熔点和沸点分别为-93.6℃和76℃。在常温常压条件下,AX3与X2气体反应生成1molAX5固体,放出热量123.8kJ。该反应的热化学方程式为_______________。
(2)在25℃、101kPa下,一定质量的无水乙醇(C2H5OH)完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为_______________。
(3)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25℃、101kPa下,已知每消耗3.8gNaBH4(s)放热21.6kJ,该反应的热化学方程式是_______________。
(4)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。已知:E(H—H)=436kJmol-1,E(Cl—Cl)=243kJmol-1,E(H—Cl)=432kJmol-1。则H2(g)+Cl2(g) =2HCl(g) ΔH=_______________。
(5)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化的示意图,请计算每生成1molNH3(g)放出热量为_______________。

【答案】AX3(l)+X2(g) =AX5(s) ΔH=-123.8kJ·mol-1 C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l) ΔH=-2QkJ·mol-1 NaBH4(s)+2H2O(l) =NaBO2(s)+4H2(g) ΔH=-216kJ·mol-1 -185kJ·mol-1 46.1kJ
【解析】
(1)根据AX3的熔沸点判断常温时的状态,结合生成lmolAX5,放出热量123.8kJ,书写反应的热化学方程式;
(2)100gCaCO3的物质的量为1mol,生成1molCaCO3要消耗0.5molC2H5OH,因此0.5molC2H5OH完全燃烧时放出热量QkJ,据此写出热化学方程式;
(3)在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,据此书写热化学方程式;
(4)依据△H=反应物键能总和-生成物键能总和计算;
(5)依据图象,生成2mol氨气反应焓变=正反应的活化能-逆反应的活化能,再计算得到1mol氨气放出的热量。
(1)AX3的熔点和沸点分别为-93.6℃和76℃,则室温时,AX3为液态,AX3与X2气体反应生成1molAX5固体,放出热量123.8kJ,该反应的热化学方程为:AX3(l)+X2(g) =AX5(s) △H=-123.8 kJ/mol,故答案为:AX3(l)+X2(g) =AX5(s) △H=-123.8 kJ/mol;
(2) 100gCaCO3的物质的量为![]() =1mol,根据C原子守恒,生成1molCaCO3需要0.5molC2H5OH,所以0.5molC2H5OH完全燃烧时放出热量QkJ,则1molC2H5OH完全燃烧时放出热量2QkJ,则乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l) △H=-2Q kJ/mol,故答案为:C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l) △H=-2QkJ/mol;
=1mol,根据C原子守恒,生成1molCaCO3需要0.5molC2H5OH,所以0.5molC2H5OH完全燃烧时放出热量QkJ,则1molC2H5OH完全燃烧时放出热量2QkJ,则乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l) △H=-2Q kJ/mol,故答案为:C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l) △H=-2QkJ/mol;
(3)3.8gNaBH4(s)物质的量为![]() =0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216kJ,则热化学方程式为NaBH4(s)+2H2O(l) =NaBO2(s)+4H2(g) △H=-216kJ/mol,故答案为:NaBH4(s)+2H2O(l) =NaBO2(s)+4H2(g) △H=-216kJ/mol;
=0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216kJ,则热化学方程式为NaBH4(s)+2H2O(l) =NaBO2(s)+4H2(g) △H=-216kJ/mol,故答案为:NaBH4(s)+2H2O(l) =NaBO2(s)+4H2(g) △H=-216kJ/mol;
(4)E(H-H) =436kJ/mol,E(Cl-Cl) =243kJ/mol ,E(H—Cl)=432 kJ/mol,H2(g)+Cl2(g) =2HCl(g) △H=反应物键能总和-生成物键能总和=436kJ/mol+243kJ/mol-2×432 kJ/mol=-185kJ/mol,故答案为:-185kJ/mol;
(5)根据N2和H2反应生成2molNH3过程中能量变化示意图,反应焓变△H=正反应的活化能-逆反应的活化能=335kJ/mol-427.2kJ/mol=-92.2kJ/mol,所以生成1mol氨气放热46.1kJ,故答案为:46.1kJ。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案