题目内容
有①Na2CO3溶液;②CH3COONa溶液、③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A、三种溶液pH的大小顺序是③>②>① |
| B、若分别加入25mL 0.1mol/L盐酸后,pH最大的是① |
| C、若将三种溶液稀释相同倍数,pH变化最大的是② |
| D、水电离出的氢离子浓度大小顺序是②>①>③ |
考点:盐类水解的应用
专题:盐类的水解专题
分析:A.物质的量浓度相等的三种溶液,强碱溶液pH最大,盐溶液中弱酸根离子水解程度越大,溶液的碱性越强;
B.反应后,①中溶质为碳酸氢钠和氯化钠、②中溶质是氯化钠和醋酸、③中溶质是氯化钠和水;
C.加水稀释促进盐类水解,稀释相同的倍数时强碱溶液pH变化最大;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸根离子水解程度越大,则水的电离程度越大.
B.反应后,①中溶质为碳酸氢钠和氯化钠、②中溶质是氯化钠和醋酸、③中溶质是氯化钠和水;
C.加水稀释促进盐类水解,稀释相同的倍数时强碱溶液pH变化最大;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸根离子水解程度越大,则水的电离程度越大.
解答:
解:A.物质的量浓度相等的三种溶液,强碱溶液pH最大,盐溶液中弱酸根离子水解程度越大,溶液的碱性越强,水解程度CO32->CH3COO-,所以这三种溶液pH大小顺序是③>①>②,故A错误;
B.反应后,①中溶质为碳酸氢钠和氯化钠、②中溶质是氯化钠和醋酸、③中溶质是氯化钠和水,①溶液呈碱性、②溶液呈酸性、③溶液呈中性,则pH最大的是①,故B正确;
C.加水稀释促进盐类水解,稀释相同的倍数时强碱溶液pH变化最大,所以③pH变化最大,故C错误;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸根离子水解程度越大,则水的电离程度越大,水解程度CO32->CH3COO-,则三种溶液中水电离出的氢离子浓度大小顺序是①>②>③,故D错误;
故选B.
B.反应后,①中溶质为碳酸氢钠和氯化钠、②中溶质是氯化钠和醋酸、③中溶质是氯化钠和水,①溶液呈碱性、②溶液呈酸性、③溶液呈中性,则pH最大的是①,故B正确;
C.加水稀释促进盐类水解,稀释相同的倍数时强碱溶液pH变化最大,所以③pH变化最大,故C错误;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸根离子水解程度越大,则水的电离程度越大,水解程度CO32->CH3COO-,则三种溶液中水电离出的氢离子浓度大小顺序是①>②>③,故D错误;
故选B.
点评:本题考查了盐类水解,明确酸根离子水解程度与酸的酸性强弱的关系是解本题关键,会根据物质浓度判断溶液pH大小、根据溶液pH判断溶液浓度大小,为常考查点,题目难度中等.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
化学源于生活,同时又服务于生活,下列说法不合理的是( )
| A、田间焚烧秸秆污染环境,浪费资源 |
| B、泄露在海洋中的大量原油能被海洋生物迅速分解,不会导致生态灾难,不需要治理 |
| C、推广使用无磷洗涤剂,可有效减少水体的富营养化 |
| D、服用铬含量超标的药用胶囊会对从体健康造成危害 |
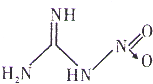 硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )
硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )| A、硝基胍分子中只含极性键,不含非极性键 |
| B、硝基胍中有C、H、O、N四种元素,属于氨基酸 |
| C、硝基胍分子中σ键与π键的个数比是5:1 |
| D、10.4 g该物质含有11×6.02×1023个原子 |
下列离子方程式正确的是( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| B、碘水中通入足量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ |
| C、NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、小苏打溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
化学与人们的生活、健康密切相关.下列做法不合理的是( )
| A、用灼烧和闻气味的方法区别棉织物和纯毛织物 |
| B、用透析的手段净化尿毒症患者的血液 |
| C、用米汤检验加碘食盐中的KI03 |
| D、向豆浆中加入盐卤制做豆腐 |
对于苯乙烯(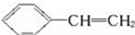 )的下列叙述:①使溴水反应褪色;②可发生加聚反应;③可溶于苯中;④可溶于水;⑤能发生取代反应;⑥所有的原子可能共平面.其中完全正确的是( )
)的下列叙述:①使溴水反应褪色;②可发生加聚反应;③可溶于苯中;④可溶于水;⑤能发生取代反应;⑥所有的原子可能共平面.其中完全正确的是( )
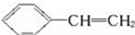 )的下列叙述:①使溴水反应褪色;②可发生加聚反应;③可溶于苯中;④可溶于水;⑤能发生取代反应;⑥所有的原子可能共平面.其中完全正确的是( )
)的下列叙述:①使溴水反应褪色;②可发生加聚反应;③可溶于苯中;④可溶于水;⑤能发生取代反应;⑥所有的原子可能共平面.其中完全正确的是( )| A、①②③⑤⑥ | B、①②⑤⑥ |
| C、①②④⑤ | D、①②③④⑤⑥ |
分子组成为C9H12的苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是( )
| A、该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 |
| B、该有机物分子中的所有原子可能在同一平面上 |
| C、该有机物的一溴代物最多有6种同分异构体 |
| D、该有机物不能发生加成反应,但能发生取代反应 |
氢氟酸(HF)对玻璃有腐蚀作用,可用在玻璃上雕刻各种精美图案,也可用在玻璃仪器上标注刻度及文字.氢氟酸与玻璃发生的反应可以表示为:SiO2+4HF=X↑+2H2O,关于物质X的组成,下列说法正确的是( )
| A、可能含有氢元素 |
| B、可能含有氧元素 |
| C、一定含有硅元素、氟元素 |
| D、X是一种氧化物 |
对于可逆反应H2(g)+I2(g)?2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A、H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B、若平衡正向移动,则V正一定增大 |
| C、正、逆反应速率的比值是恒定的 |
| D、达到平衡时,正、逆反应速率相等 |