题目内容
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.(As为砷元素)
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知0.2mol KBrO3在反应中得到1mol电子生成1mol X,则X的化学式为
(3)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4 b.H3ASO4是还原产物
c.还原性:AsH3>X d.K2SO4和H2O是还原产物
(4)请将反应物的化学式和配平后的系数填入下列相应的位置中,并用“单线桥”标出电子转移的方向和数目.

(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
AsH3
AsH3
.(2)已知0.2mol KBrO3在反应中得到1mol电子生成1mol X,则X的化学式为
Br2
Br2
.(3)根据上述反应可推知
ac
ac
.a.氧化性:KBrO3>H3AsO4 b.H3ASO4是还原产物
c.还原性:AsH3>X d.K2SO4和H2O是还原产物
(4)请将反应物的化学式和配平后的系数填入下列相应的位置中,并用“单线桥”标出电子转移的方向和数目.

分析:(1)化合价升高元素所在的反应物是还原剂;
(2)根据溴元素化合价的降低情况来计算;
(3)氧化剂的氧化性最强,还原剂的还原性最强,氧化剂对应的产物叫还原产物;
(4)根据化学反应中化合价的升降情况标电子转移情况.
(2)根据溴元素化合价的降低情况来计算;
(3)氧化剂的氧化性最强,还原剂的还原性最强,氧化剂对应的产物叫还原产物;
(4)根据化学反应中化合价的升降情况标电子转移情况.
解答:解:(1)KBrO3在反应中得到电子,所以KBrO3是氧化剂,AsH3变成了H3AsO4,所以AsH3是还原剂,故答案为:AsH3;
(2)设X中溴元素的化合价为x,则0.2mol(5-x)=1mol,所以x=0,故X为Br2,故答案为:Br2;
(3)a、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故a正确;
b、AsH3变成了H3AsO4,砷元素化合价升高,所以H3ASO4是氧化产物,故b错误;
c、AsH3是还原剂,Br2是还原产物,所以还原性AsH3>Br2,故c正确;
d、K2SO4和H2O中的元素化合价均未变化,既不是氧化产物也不是还原产物,故d错误.
故选ac.
(4)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,化合价升高和降低数目得相等,所以转移40e-,故答案为: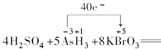 .
.
(2)设X中溴元素的化合价为x,则0.2mol(5-x)=1mol,所以x=0,故X为Br2,故答案为:Br2;
(3)a、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故a正确;
b、AsH3变成了H3AsO4,砷元素化合价升高,所以H3ASO4是氧化产物,故b错误;
c、AsH3是还原剂,Br2是还原产物,所以还原性AsH3>Br2,故c正确;
d、K2SO4和H2O中的元素化合价均未变化,既不是氧化产物也不是还原产物,故d错误.
故选ac.
(4)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,化合价升高和降低数目得相等,所以转移40e-,故答案为:
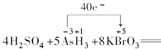 .
.点评:本题考查学生氧化还原反应中的概念以及电子守恒定律的知识,综合性较强,难度较大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。已知0.1mol KBrO3在反应中得到0.5mol电子生成X,则下列说法错误的是
| A.氧化产物与还原产物的计量系数之比为5:2 | B.氧化性:KBrO3>H3AsO4 |
| C.AsH3中As元素被氧化,发生氧化反应 | D.X的化学式为Br2 |