题目内容
根据下列叙述,写出元素名称并画出原子结构示意图.(1)A元素原子核外M层电子数是L层电子数的一半:__________.
(2)B元素原子的最外层电子数是次外层电子数的1.5倍:__________.
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃:__________.
(4)D元素的次外层电子数是最外层电子数的1/4:__________.
解析:
| 解析:(1)L层有8个电子,则M层有4个电子,故A为 (2)当次外层为K层时,最外层电子数则为3,是 (3)单质在常温下与水剧烈反应产生O2的是F2. (4)当次外层为K层时,D为
|

 阅读快车系列答案
阅读快车系列答案某学生要用50 mL NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石⑥饱和NaHCO3溶液
实验室有下列仪器:量筒,烧杯,橡皮管,玻璃导管,分液漏斗,烧杯,洗气瓶,酒精灯。
已知下表中各物质在常温时的溶解度(g/100 g H2O)
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
本实验除了下面图给的仪器外,还应有: (仪器安装补完整)。
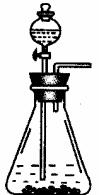
实验为保证制得Na2CO3的纯度,应选用的药品,除①外,还应需要: 。
简要叙述实验步骤,直到制得纯碳酸钠溶液 。
根据给出的溶解度表,若保证在配制过程中不会有晶体析出,所用氢氧化钠溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
某学生要用50 mL NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石⑥饱和NaHCO3溶液
实验室有下列仪器:量筒,烧杯,橡皮管,玻璃导管,分液漏斗,烧杯,洗气瓶,酒精灯。
已知下表中各物质在常温时的溶解度(g/100 g H2O)
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
本实验除了下面图给的仪器外,还应有: (仪器安装补完整)。
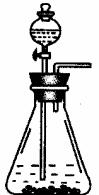
实验为保证制得Na2CO3的纯度,应选用的药品,除①外,还应需要: 。
简要叙述实验步骤,直到制得纯碳酸钠溶液 。
根据给出的溶解度表,若保证在配制过程中不会有晶体析出,所用氢氧化钠溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2
+[O]-Q 平衡常数为K1 ;
O2
+[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
|
pH t / min T / ℃ |
3.0 |
4.0 |
5.0 |
6.0 |
|
20 |
301 |
231 |
169 |
58 |
|
30 |
158 |
108 |
48 |
15 |
|
50 |
31 |
26 |
15 |
7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
