题目内容
下列有关元素的性质及其递变规律正确的是
| A.Ⅰ A族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B.第二周期元素从左到右,最高正价从+1递增到+7,最低负价从—4升高到—1 |
| C.同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D.同周期主族金属元素的化合价越高,其原子失电子能力越强 |
C
解析试题分析:A项H与ⅦA族元素间形成的化合物中含共价键,如HCl,错误;B项 F没有正价,错误;D项失电子能力的强弱不能通过化合价判断,如Na为+1,Al为+3,而是电子能力Na>Al.错误。
考点:元素周期律。

练习册系列答案
相关题目
X、Y、Z、M、N代表五种金属,有以下化学反应:
①水溶液中:X+Y2+=X2++Y;
②Z+2H2O(冷)=Z(OH)2+H2↑;
③M、N为电极与N盐溶液组成原电池,负极反应为:M-2e-=M2+;
④Y可以溶于稀H2SO4中,M不能被H2SO4氧化,则这五种金属的活动性由弱到强的顺序是
| A.M<N<Y<X<Z | B.N<M<Y<X<Z |
| C.N<M<X<Y<Z | D.X<Z<N<M<Y |
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1∶1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
下列各基态原子或离子的电子排布式错误的是
| A.Al 1s22s22p63s23p1 | B.S2- 1s22s22p63s23p4 |
| C.Na+ 1s22s22p6 | D.F 1s22s22p5 |
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
下列说法正确的是( )
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:Y>X |
| D.X、Z形成的化合物中可能含有共价键 |
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是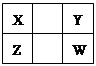
| A.Z元素的原子半径可能比Y元素的小 |
| B.Z的原子序数不可能是X的原子序数的2倍 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的最高价氧化物的水化物的酸性一定比W的强 |
具有下列电子层结构的原子,其相应元素一定属于同一主族的是
| A.3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 |
| B.3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 |
| C.最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子 |
| D.最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 |
应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |