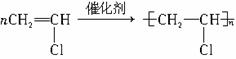
题目内容
(18分)下列八个步骤是用来分析一种含铅锡的合金中铅和锡的个别含量
(1)称量0.4062g的合金,放在烧杯中,用11mol?L-1的HCl和16mol?L-1的HNO3溶液溶解样品。在此过程中铅和锡分别被氧化成Pb(II)、Sn(VI)。
(2)再加热5分钟,以赶走氮和氯的氧化物后,使溶液冷却;此时会有一些锡化合物和一种铅化合物沉淀出。
(3)加入25.00mL 0.2000mol?L-1的Na2H2EDTA(可用H2Y2-表示)溶液后,沉淀会溶解成一透明无色的溶液。
(4)上述溶液全部移入250.0mL的量瓶中,并用蒸馏水稀释到量瓶的刻度上。
(5)拿出25.00mL,加入30%的Hexamine(如下图)溶液15mL、H2O及两滴的类苯酚橙(以XO代表)(如下图)当指示剂,此溶液的pH值为6。
(6)再用标准0.009970mol?L-1的硝酸铅Pb(NO3)2 溶液滴定从第(5)步骤中的黄色透明的溶液,直至颜色刚好由黄色变到红色,此实验值为24.05mL。
(7)取2.0g的固体NaF加入滴定瓶中,此时溶液会变回黄色。
(8)再用0.009970mol?L-1的硝酸铅滴定到颜色变红,此实验值为15.00mL。
Hexamine和类苯酚橙(XO)的结构式如下:
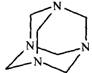
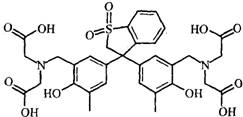
Hexamine 类苯酚橙(XO)
Hexamine的pKb =9.5。类苯酚橙(XO)在pH小于4时是红色,pH大于5时是黄色
回答下列问题
10-1 在步骤(2)中铅的沉淀物是什么?写出其化学式。
10-2 写出步骤(3)中沉淀消失的离子反应方程式(必须平衡)?记得此溶液的pH值为6。
10-3 步骤(5)中为何加入Hexamine?
10-4 加入类苯酚橙(XO)的目的为何?
10-5 写出步骤(6)中,(i)在滴定过程中,以及(ii)滴定终点造成颜色变化时的平衡离子反应方程式。
10-6 步骤(7)中,加入NaF的目的为何?
10-7 写出步骤(7)中的平衡离子方程式。
10-8 用平衡的离子方程式来说明为什么步骤(7)中的颜色会由红变为黄?用XO代表类苯酚橙。
10-9 计算此合金中Pb的重量百分比,再另外计算此合金中Sn的重量百分比。
10-1 PbCl2或任何含(OH)的物种等等…(1分)
10-2 PbCl2(s)+H2Y2-→PbY2-+2H++2Cl-(2分)
10-3 作为pH缓冲剂(1分)
10-4 金属络合指示剂(1分)
10-5 由步骤(5),标准Pb溶液是用来络合过量EDTA,部份EDTA已成为稳定SnY和PbY2-配合物;在pH=6,EDTA主要以H2Y2-存在,因此:Pb2++H2Y2-→PbY2-+2H+或类此反应式到达终点,一小量多出的Pb2+就会和XO指示剂形成一红色配合物:Pb2++XO(黄)→PbXO2+(红) 或类此反应式。滴定可以用以计算过量的EDTA,因此Sn+Pb之总含量可以决定。(4分)
10-6 和Sn络合(1分)
10-7 SnY+nF-+2H+→SnFn(n-4)+H2Y2-(1分)
10-8 所释出EDTA毁掉小量红色PbXO络合物,产生游离(黄色)XO(忽略XO上的电荷)H2Y2-+PbXO2+→PbY2-+XO(黄色)+2H+或类似方程式(2分)
10-9 Sn:100×(0.176/0.4062)=43.72%
Pb:100×(0.2292/0.4062)=56.42 %(5分)