题目内容
【题目】将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )
A.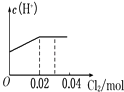
B.
C.
D.
【答案】A
【解析】解:亚硫酸根离子与溴离子都具有还原性,但是亚硫酸根离子还原性强于溴离子,通入氯气后,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br﹣.
氯气氧化亚硫酸生成硫酸:
Cl2 + | H2SO3 +H2O= | H2SO4 + | 2HCl |
0.02mol | 0.02mol | 0.02mol | 0.04mol |
H2SO3为弱酸,生成两种强酸:H2SO4和HCl,c(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化Br﹣:
Cl2 +2HBr=Br2 + | 2HCl |
0.01mol | 0.02mol |
HBr全部被氯气氧化转变为Br2 和HCl,HCl和HBr都是强酸,所以c(H+)不变;
故选:A.
【考点精析】解答此题的关键在于理解氯气的化学性质的相关知识,掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目


