题目内容
20.下列现象与氢键有关的是( )①NH3的熔沸点比第ⅤA族相邻元素的氢化物高
②NH3易溶于水
③冰的密度比液态水的密度小
④尿素的熔沸点比醋酸的高
⑤邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
分析 ①ⅤA族中,N的非金属性最强,NH3中分子之间存在氢键;
②NH3与水分子之间能形成氢键;
③冰中存在氢键,其体积变大;
④尿素分子间可以形成多个氢键(2个N原子、1个O原子),醋酸分子间只有1个氢键(只有羟基可以形成氢键);
⑤对羟基苯甲酸易形成分子之间氢键;
⑥稳定性与化学键有关.
解答 解:①因第①ⅤA族中,N的非金属性最强,NH3中分子之间存在氢键,则NH3的熔、沸点比ⅦA族其他元素氢化物的高,故①正确;
②NH3与水分子之间能形成氢键,则NH3易溶于水,故②正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③正确;
④尿素分子间可以形成的氢键比醋酸分子间形成的氢键多,尿素的熔、沸点比醋酸的高,故④正确;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故⑤正确;
⑥水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,故⑥错误;
故选B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
11.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,22.4L CCl4中含有共用电子对数目为4.0NA | |
| B. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.2NA | |
| C. | 1 mol CO2与1 mol Na2O2完全反应时,转移的电子数目为NA | |
| D. | 9.2 g NO2气体中含有分子数目为0.2NA |
15.1,5-戊二醛(简称GA)是一种重要的饱和直链二元醛.2%的GA溶液对禽流感、口蹄疫等疾病有良好的防治作用.根据上述信息,判断下列说法中正确的是( )
| A. | 戊二醛的分子式为C5H8O2,符合此分子式的二元醛有5种 | |
| B. | 戊二醛不能使酸性高锰酸钾溶液褪色 | |
| C. | 戊二醛经催化氧化可以得到的戊二酸有4种同分异构体 | |
| D. | 1mol的戊二醛与足量的银氨溶液反应,最多可得2mol单质银 |
5.重水(D2O)是重要的核工业原料,下列说法错误的是( )
| A. | 氘(D)原子核外有1个电子 | |
| B. | 1H218O与D216O的相对分子质量相同 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H与D互称同位素 |
9.下列各选项陈述Ⅰ和陈述Ⅱ均正确且二者有因果关系的是( )
| 陈述Ⅰ | 陈述Ⅱ | |
| A | NaHCO3为强碱弱酸盐,只存在水解平衡 | NaHCO3溶液显碱性 |
| B | HCL与Na2CO3溶液反应生成CO2 | 用饱和NaCO3溶液除去CO2中的少量HCl |
| C | Cl2使润湿的有色布条褪色,而干燥的布条不褪色 | 次氯酸的氧化性比氯气的强 |
| D | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| A. | A | B. | B | C. | C | D. | D |
10.下列叙述中正确的是( )
| A. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| B. | 化合反应和置换反应均为氧化还原反应 | |
| C. | 能够电离出H+的物质一定是酸 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
 的名称为2-甲基-2,4-己二烯.
的名称为2-甲基-2,4-己二烯. 该物质所含官能团的名称分别为羟基、酯基、羧基.
该物质所含官能团的名称分别为羟基、酯基、羧基. 进行一氯取代反应后,只能生成3种沸点不同产物.
进行一氯取代反应后,只能生成3种沸点不同产物.
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$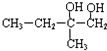 +2NaBr,反应类型是取代反应.
+2NaBr,反应类型是取代反应.