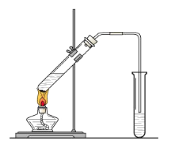
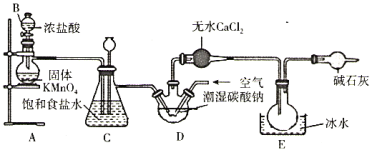
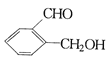
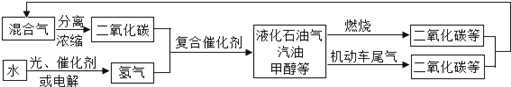
��Ŀ����
����Ŀ������������(Mn3O4)�㷺Ӧ�����������Ų��ϡ��������Ʊ�����һ���Ե�Ʒλ�̿�(��MnCO3��Mn2O3��MnOOH������Fe2O3��Al2O3��SiO2)Ϊԭ������Mn3O4�Ĺ���������ͼ��

��֪��![]()
�ش��������⣺
(1) MnOOH��MnԪ�صĻ��ϼ�Ϊ________��
(2)���ܽ�����H2O2��������________��
(3)������2������Ҫ�ɷ���________��
(4)��ĸҺ�������ʵ���Ҫ�ɷ���________��ѭ�����ø����ʵķ�����________��
(5)��������ʱ�����������ˮ�У�70��ˮԡ���ȣ�ͨ����������������ȫ��ת��ΪMn3O4��Mn(OH)2����Mn3O4��Ӧ�Ļ�ѧ����ʽΪ________����Ӧ����Һ��![]() ________(����������������С������������)��
________(����������������������������)��
���𰸡�+3 ��+3��MnԪ�ػ�ԭ��Mn2+ Fe(OH)3��Al(OH)3 (NH4)2SO4 ���ȵ�213~308��ֽ����ɰ�����NH4HSO4���ֱ�ѭ�������̺��ܽ��л��H2SO4����NH4HSO4ѭ�����ܽ��� ![]() ��С
��С
��������
�̿��(��MnCO3��Mn2O3��MnOOH������Fe2O3��Al2O3��SiO2)����NH4HSO4��H2O2�ܽ���MnCO3��Mn2O3��MnOOHת��ΪMn2+��Fe2O3��Al2O3ת��ΪFe3+��Al3+��SiO2���ܶ�������1������Mn(OH)2����pH=5����ʱFe3+��Al3+ת��ΪFe(OH)3��Al(OH)3��������2�����백ˮ���̣���ʱ��ת��ΪMn(OH)2��Mn2(OH)2SO4��ͨ����������70��ˮԡ���ȣ����õ�Mn3O4��
(1)MnOOH��OԪ��Ϊ-2�ۣ�HԪ��Ϊ+1�ۣ������������ϼ۴�����Ϊ0���㣬Mn�Ļ��ϼ�Ϊ+3�ۣ�
(2)���ܽ����У���һ����Mn��+3�۽�Ϊ+2�ۣ�����H2O2�������ǽ�+3�۵�Mn��ԭΪMn2+��
(3)������������֪��������2������Ҫ�ɷ�ΪFe(OH)3��Al(OH)3��
(4)��������������ĸҺ������Ϊ(NH4)2SO4��ѭ�����ø����ʵķ����ǣ����ȵ�213~308��ֽ����ɰ�����NH4HSO4���ֱ�ѭ�������̺��ܽ��л��H2SO4����NH4HSO4ѭ�����ܽ��У�
(5)����ʱ��Mn(OH)2����70��ˮԡ���ȣ�ͨ��������������Mn3O4����Ӧ����ʽΪ![]() ��Mn(OH)2�ʼ��ԣ�Mn3O4������ˮ����Ӧ������Mn(OH)2��Ũ�Ƚ��ͣ����Է�Ӧ����ҺpH��С��
��Mn(OH)2�ʼ��ԣ�Mn3O4������ˮ����Ӧ������Mn(OH)2��Ũ�Ƚ��ͣ����Է�Ӧ����ҺpH��С��

 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�