��Ŀ����
����Ŀ������̫���ܵ�ص���Ҫ���ϡ���ҵұ�������ԭ���ǣ�
�ֹ�ұ������SiO2 + 2C![]() Si + 2CO
Si + 2CO
�����裺��Si + 3HCl![]() SiHCl3 + H2
SiHCl3 + H2
��SiHCl3 + H2![]() Si + 3HCl
Si + 3HCl
��ѧ��Ӧ�������仯��ͼ��ʾ���ش��������⣺
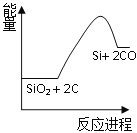

��1����Ӧ����_________��Ӧ(��������������������)����Ӧ����_________��Ӧ(��������������������)��
��2����Ӧ���ƻ���Ӧ���еĻ�ѧ�������յ�����_________�γ��������л�ѧ�����ų�������(��������������С����)��
��3���о����ʱ仯ʱ�����ǿ��ԴӲ�ͬ�Ƕȡ���ͬ��������ʶ���ʱ仯ʱ������Ļ�ѧ���������仯���ݴ��ж�����˵���������_________(˫ѡ)��
A�������ƺ�������Ӧ�����Ȼ��ƺ���ṹ���ȶ�����ǿ����ϵ����������
B���������������������ֱ���ȫȼ�գ�ǰ�߷ų���������
C�����������ڲ������ź�ǿ�Ĺ��ۼ�����ͨ��״���µ����Ļ�ѧ���ʺܻ���
D����ʯī��ȡ���ʯ�����ȷ�Ӧ����֪���ʯ��ʯī�ȶ�
E���ɷ��ȷ�ӦH2 + Cl2 ==== 2HCl��˵������1mol H��H����1molCl��Cl�������յ�����С���γ�2molH��Cl�����ų�������
��4�����о���ѧ��Ӧ�е������仯ʱ������ͨ����������ʵ�飺
��һ��С�ձ������20g�Ѿ���ĥ�ɷ�ĩ�������������塾Ba(OH)2.8H2O������С�ձ����������ѵ���3��4��ˮ�IJ���Ƭ�ϣ�Ȼ�����ձ��м���Լ10gNH4Cl���壬�������ò�����Ѹ�ٽ��衣д��ʵ������з�����Ӧ�Ļ�ѧ����ʽ_________���÷�Ӧ�з�Ӧ��������_________�������������(��������������С����)��ʵ������������ò�����Ѹ�ٽ����ԭ����_________��
���𰸡�
��1��������������
��2��������
��3��CD
��4��2NH4Cl + Ba(OH)2.8H2O = BaCl2 + 2NH3 + 10H2O��С��������Ӧ��ĽӴ�������ӿ췴Ӧ����
��������
�����������1����Ӧ���ķ�Ӧ�����������������������������������ȷ�Ӧ����Ӧ���ķ�Ӧ�����������������������������ڷ��ȷ�Ӧ���ʴ�Ϊ�����ȣ����ȣ�
��2������ͼ����Ӧ���ķ�Ӧ�����������������������������������ȷ�Ӧ���ƻ���Ӧ���еĻ�ѧ�������յ����������γ��������л�ѧ�����ų����������ʴ�Ϊ�����ڣ�
��3��A�������ƺ�������Ӧ�����Ȼ������ڷ��ȷ�Ӧ���������ṹ���ȶ�����ǿ����ϵ��������������A��ȷ��B��������ת��Ϊ�������ȣ��������������������ֱ���ȫȼ�գ�ǰ�߷ų�������������B��ȷ��]C�����������ڲ������ź�ǿ�Ĺ��ۼ���ʹ�õ������Ӻ��¶ȣ�ͨ��״���µ����Ļ�ѧ���ʺ�����������C����D����ʯī��ȡ���ʯ�����ȷ�Ӧ�����ʯ������������ʯī��û��ʯī�ȶ�����C����E��H2 + Cl2 ==== 2HCl�Ƿ��ȷ�Ӧ������1mol H��H����1molCl��Cl�������յ�����С���γ�2molH��Cl�����ų�����������E��ȷ����ѡCD��
��4��ʵ����������������������Ȼ�立�Ӧ�����˰������Ȼ�������Ӧ�Ļ�ѧ����ʽΪ2NH4Cl + Ba(OH)2.8H2O = BaCl2 + 2NH3 + 10H2O���÷�Ӧ�������ȷ�Ӧ����Ӧ��������С�����������������ʵ������������ò�����Ѹ�ٽ�������������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�ʹ����������ԣ��ʴ�Ϊ��2NH4Cl + Ba(OH)2.8H2O = BaCl2 + 2NH3 + 10H2O��С�ڣ�����Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�

����Ŀ������ͭ���壬�׳����������������д��£�����ⶾ��ȡ5.0 g������Ʒ�������¶�ʹ��ֽ⣬�ֽ���̵��������±����ش��������⣺
�¶ȷ�Χ/�� | ��������/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000���� | 1.44 |
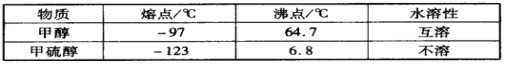
��1���ⶨ�������ھ��������������____________������SO42-��Sԭ�ӵĹ���ӻ���ʽ��____________��H2O�Ŀռ乹����__________________��
��2��������ͭ������ȵ�258~680�����ɵ�����A��A��__________����ѧʽ����A����ˮ�����Һ�����백ˮ���۲쵽��������_____________________________________________�����յõ���Һ�еĺ�ͭԪ�ص�������_________________����ѧʽ���������Ӻ��еĻ�ѧ��������___________________��
��3��������ͭ������ȵ�1000���������ɵ�����C����C�е�ͭ�����ӵĻ�̬�����Ų�ʽ��____________��
��4����ͼ������ͭ����ֽ�õ�һ���¶ȵIJ���ľ���������ͺ��������ͬ��ԭ������

�����¶���_______________��
��ͭԭ�ӵ���λ����_______________��
����֪�þ�����ܶ�Ϊdg��cm-3����������_________________pm��
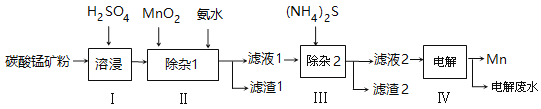
����Ŀ���̵���;�dz��㷺����̼���̿�(��Ҫ�ɷ�ΪMnCO3�����������������ܵ�̼����������Ϊԭ�����������̵Ĺ����������£�
��֪25�����������ʵ��ܶȻ��������£�
���� | Mn(OH��2 | Co(OH��2 | Ni(OH��2 | MnS | CoS | NiS |
Ksp | 2.1��10-13 | 3.0��10-16 | 5.0��10-16 | 1.0��10-11 | 5.0��10-22 | 1.0��10-22 |
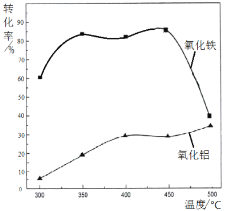
��1���������У�Ϊ�ӿ��ܽ����ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ� ��
��2���������У���Ӱ�ˮ������Һ��pHΪ5.0��6.0��������1����Ҫ�ɷ�Ϊ ���ѧʽ������֪MnO2������Ϊ����������õ�������1���漰�����ӷ���ʽΪ �� ��
��3���������У�����(NH4��2S��Ũ�Ȳ��˹����ԭ���� ��
��4����Һ2�У�c(Co2+����c(Ni2+��= ��
��5��������Ϊakg��̼���̿��������̴�����õ�����Mn b kg����ÿһ����������ȫ������1Ϊ���������Ϊc kg����ԭ̼���̿���MnCO3����������Ϊ �����ú�a��b��c��ʽ�ӱ�����軯��