题目内容
(16分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
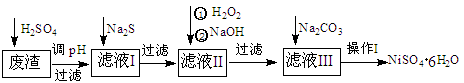
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,其目的是: _____ ________ 。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:______________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解,蒸发浓缩,冷却结晶,洗涤获得产品。

(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,其目的是: _____ ________ 。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:______________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解,蒸发浓缩,冷却结晶,洗涤获得产品。
(1)S2-+Cu2+= CuS↓(3分) (2)减少过氧化氢的分解(3分)
(3)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O(3分)
(4)Na2SO4 NiSO4 (4分,漏选得1分,错选不给分) (5)H2SO4(3分)
(3)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O(3分)
(4)Na2SO4 NiSO4 (4分,漏选得1分,错选不给分) (5)H2SO4(3分)
(1)硫化铜是难溶于水的沉淀,反应原理是复分解反应,方程式为S2-+Cu2+= CuS↓。
(2)双氧水不稳定,受热易分解,所以温度不能太高的原因是减少过氧化氢的分解。
(3)氧化剂氯酸钠的还原产物是氯化钠,转移6个电子,所以根据电子得失守恒可知,方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O。
(4)由于经过前面的除杂,Cu、Zn、Fe、Cr等杂质均以沉淀的形式而被过滤出来,所以滤液中的主要成分是Na2SO4、NiSO4。
(5)为了减少NiSO4的溶解,洗涤时应该用硫酸。
(2)双氧水不稳定,受热易分解,所以温度不能太高的原因是减少过氧化氢的分解。
(3)氧化剂氯酸钠的还原产物是氯化钠,转移6个电子,所以根据电子得失守恒可知,方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O。
(4)由于经过前面的除杂,Cu、Zn、Fe、Cr等杂质均以沉淀的形式而被过滤出来,所以滤液中的主要成分是Na2SO4、NiSO4。
(5)为了减少NiSO4的溶解,洗涤时应该用硫酸。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2Na+Cl2↑
2Na+Cl2↑ 2Al+3H2O
2Al+3H2O 2Hg+O2↑
2Hg+O2↑