题目内容
某状态下将1molO2、2molSO2和1molSO3的混合气体压入装有V2O5的密闭容器中平衡时测得混合气体对H2的相对密度为28.5。
求:①反应前混合气体的平均分子量;
②平衡混合气体的平均分子量;
③根据上述计算结果,写出原混合气发生反应的化学方程式;
④求反应的转化率。
求:①反应前混合气体的平均分子量;
②平衡混合气体的平均分子量;
③根据上述计算结果,写出原混合气发生反应的化学方程式;
④求反应的转化率。
①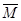 =
=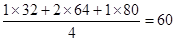
② =2×28.5=57
=2×28.5=57
③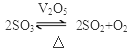
④ 2SO3 2SO2 + O2
2SO2 + O2
起始(mol): 1 2 1
转化(mol): x x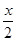
平衡(mol): 1-x 2+x. 1+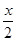
∴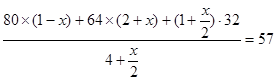
x="42.1%"
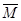 =
=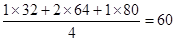
②
 =2×28.5=57
=2×28.5=57③
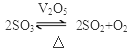
④ 2SO3
 2SO2 + O2
2SO2 + O2起始(mol): 1 2 1
转化(mol): x x
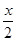
平衡(mol): 1-x 2+x. 1+
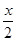
∴
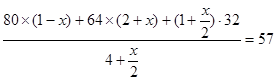
x="42.1%"
考查可逆反应的有关计算。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
 2Z,其平衡常数为1600
2Z,其平衡常数为1600 2NO2(气)+热量,不能说明已达到平衡状态的是( )
2NO2(气)+热量,不能说明已达到平衡状态的是( ) 正(NO2) =
正(NO2) = bB(气) + cC(气), 在温度不变的条件下,再充入一定量的A物质, 重新达到平衡时, 下列判断中正确的是:( )
bB(气) + cC(气), 在温度不变的条件下,再充入一定量的A物质, 重新达到平衡时, 下列判断中正确的是:( ) nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则
nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则
 ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题: 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”), (混合气)将 (填写“变大”、“变小”或“不变”);
(混合气)将 (填写“变大”、“变小”或“不变”); C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是