题目内容
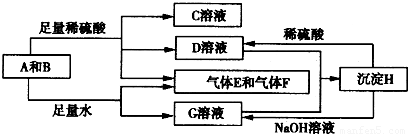
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应:

请回答下列问题:
(1)组成A单质的元素在周期表中处于第______周期______族.
(2)化合物B的电子式为______.
(3)D与G两溶液混合后发生反应的离子方程式为______.
(4)常温下,D溶液的pH______7(填“>”、“<”或“=”),其原因是______(用离子方程式表示).
(5)10.8g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为______g.
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______.以该电池为电源,用惰性电极电解100g 8%的C溶液,当电解到溶质的质量分数为l2.5%时停止电解,则电解过程中,生成的气体在标准状况下的体积共为______L,电路上通过电子的物质的量为______mol.
解:沉淀H既能与稀硫酸反应,又能与NaOH溶液反应,而D、G两溶液混合可以生成H,故为两性氢氧化物Al(OH)3,故A为铝,B为Na2O2,C、D、G分别为Na2SO4、Al2(SO4)3、NaAlO2,
(1)A为Al,原子核外有3个电子层,最外层电子数为3,则位于周期表第三周期第ⅢA族,故答案为:3;ⅢA;
(2)化合物B为Na2O2,为离子化合物,电子式为 ,故答案为:
,故答案为: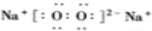 ;
;
(3)D、G分别为Al2(SO4)3、NaAlO2,Al3+与AlO2-可发生互促水解生成Al(OH)3,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)D为Al2(SO4)3,为强酸弱碱盐,在溶液中发生Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,故答案为:<;Al3++3H2O?Al(OH)3+3H+;
(5)铝与氢氧化钠溶液反应的氧化剂是水,0.4mol铝转移电子数为1.2mol,消耗水的物质的量为1.2mol,则水的质量为:18g/mol×1.2mol/=21.6g,故答案为:21.6;
(6)电解Na2SO4溶液,实际上是电解的水,电解水的化学方程式为2H2O 2H2↑+O2↑,电池的正极反应式为O2+4H++4e-=2H2O,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子,
2H2↑+O2↑,电池的正极反应式为O2+4H++4e-=2H2O,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子,
故答案为:O2+4H++4e-=2H2O;67.2;4.
分析:沉淀H既能与稀硫酸反应,又能与NaOH溶液反应,而D、G两溶液混合可以生成H,故为两性氢氧化物Al(OH)3,故A为铝,B为Na2O2,C、D、G分别为Na2SO4、Al2(SO4)3、NaAlO2.铝与氢氧化钠溶液反应的氧化剂是水,0.4mol铝转移电子数为1.2mol,消耗水的物质的量为1.2mol,则水的质量为:18g/mol×1.2mol/=21.6g,电解Na2SO4溶液,实际上是电解的水,电解水的化学方程式为2H2O 2H2↑+O2↑,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子.
2H2↑+O2↑,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子.
点评:本题综合考查无机物的推断,题目难度较大,注意以H的转化关系为该题的突破口,明确物质的种类为解答该类题目的关键,注意相关物质的性质以及利用化学方程式的计算.
(1)A为Al,原子核外有3个电子层,最外层电子数为3,则位于周期表第三周期第ⅢA族,故答案为:3;ⅢA;
(2)化合物B为Na2O2,为离子化合物,电子式为
 ,故答案为:
,故答案为: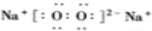 ;
;(3)D、G分别为Al2(SO4)3、NaAlO2,Al3+与AlO2-可发生互促水解生成Al(OH)3,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)D为Al2(SO4)3,为强酸弱碱盐,在溶液中发生Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,故答案为:<;Al3++3H2O?Al(OH)3+3H+;
(5)铝与氢氧化钠溶液反应的氧化剂是水,0.4mol铝转移电子数为1.2mol,消耗水的物质的量为1.2mol,则水的质量为:18g/mol×1.2mol/=21.6g,故答案为:21.6;
(6)电解Na2SO4溶液,实际上是电解的水,电解水的化学方程式为2H2O
 2H2↑+O2↑,电池的正极反应式为O2+4H++4e-=2H2O,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子,
2H2↑+O2↑,电池的正极反应式为O2+4H++4e-=2H2O,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子,故答案为:O2+4H++4e-=2H2O;67.2;4.
分析:沉淀H既能与稀硫酸反应,又能与NaOH溶液反应,而D、G两溶液混合可以生成H,故为两性氢氧化物Al(OH)3,故A为铝,B为Na2O2,C、D、G分别为Na2SO4、Al2(SO4)3、NaAlO2.铝与氢氧化钠溶液反应的氧化剂是水,0.4mol铝转移电子数为1.2mol,消耗水的物质的量为1.2mol,则水的质量为:18g/mol×1.2mol/=21.6g,电解Na2SO4溶液,实际上是电解的水,电解水的化学方程式为2H2O
 2H2↑+O2↑,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子.
2H2↑+O2↑,即消耗2mol水共生成3mol气体,标准状况下体积为67.2L,转移4mol电子.点评:本题综合考查无机物的推断,题目难度较大,注意以H的转化关系为该题的突破口,明确物质的种类为解答该类题目的关键,注意相关物质的性质以及利用化学方程式的计算.

练习册系列答案
相关题目
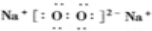

 Al(OH)3+3H+
Al(OH)3+3H+