题目内容
9.已知0.1mol•L-1的三元酸H3A溶液的pH=4.0,则下列说法中正确的是( )| A. | 在Na3A、Na2HA、NaH2A三溶液中,离子种类不相同 | |
| B. | 在溶质物质的量相等的Na3A、Na2HA、NaH2A三溶液中阴离子总数相等 | |
| C. | 在NaH2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(H2A-)+c(HA2-)+c(A3-) | |
| D. | 在Na3A溶液中一定有:c(H+)=c(OH-)-c(HA2-)-2c(H2A-)-3c(H3A) |
分析 已知0.1mol•L-1的三元酸H3A溶液的pH=4.0,说明溶液为弱酸;
A、在Na3A、Na2HA、NaH2A溶液中,A3离子水解,H2A-、HA2-存在电离和水解;
B、依据物料守恒判断;
C、依据溶液中电荷守恒计算判断;
D、A3-离子分步水解,溶液呈碱性,根据质子守恒分析.
解答 解:A、在Na3A、Na2HA、NaH2A溶液中,A3离子水解,H2A-、HA2-存在电离和水解,所以溶液中离子种类相同,故A错误;
B、在溶质物质的量相等的Na3A、Na2HA、NaH2A三溶液中阳离子Na+的物质的量不同,所以阴离子总数不相同,故B错误;
C、在NaHA溶液中一定有电荷守恒,结合溶液中离子种类写出电荷守恒:c(Na+)+c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-),故C错误;
D、在Na3A溶液中,A3-离子分步水解,溶液呈碱性,溶液中存在质子守恒,即水电离的氢离子与水电离的氢氧根离子相同,则c(OH-)=c(H+)+c(HA2-)+2c(H2A-)+3c(H3A),所以c(H+)=c(OH-)-c(HA2-)-2c(H2A-)-3c(H3A),故D正确;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较方法,溶液中电荷守恒的分析判断,溶液中离子的特征性质和水解、电离是解题关键,题目难度中等.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
20.25℃的四种溶液:①pH=2的CH3COOH溶液 ②pH=2的HCl溶液 ③pH=12的氨水 ④pH=12的NaOH溶液.有关上述溶液的比较中,正确的是( )
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
4.下列说法不正确的是( )
| A. | “冰,水为之,而寒于水”说明相同质量的液态水和冰,液态水的能量高 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒直径不相同 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 用福尔马林灭掉活埃博拉病毒是利用了蛋白质变性原理 |
1.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=14的溶液中:K+、Ca2+、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10的溶液中:Na+、NH4+、SO42-、NO3- | |
| C. | c(ClO-)=1.0mol•L-1的溶液中:Na+、SO32-、S2-、SO42- | |
| D. | 0.1 mol•L-1的NaAlO2溶液中:NH4+、Fe3+、Cl-、I- |
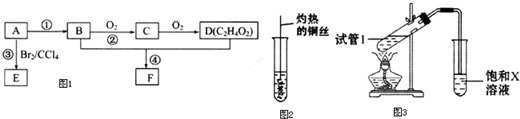
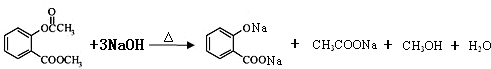
 .
.
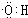 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.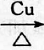 2CH3CHO+2H2O.
2CH3CHO+2H2O.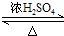 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.