题目内容
【题目】0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子,0.4gX的单质与足量盐酸充分反应放出0.02g氢气,X中质子数和中子数相等,Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸
(1)推断X、Y两元素的名称及在周期表中的位置
(2)用电子式表示X、Y形成化合物的过程.
【答案】
(1)解:0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子,X离子得电子被还原,电子的物质的量是1mol,二者的物质的量之比等于微粒个数之比,则每个X离子得到2个电子生成原子或单质;
0.4gX的单质与足量盐酸充分反应放出0.02g氢气,则X是金属元素,其阳离子为二价阳离子,X与盐酸反应生成金属阳离子时,根据转移电子守恒得n(H2)=n(X),M(X)= ![]() =40g/mol,其相对原子质量为40,X中质子数和中子数相等,则X质子数是20,为Ca元素;
=40g/mol,其相对原子质量为40,X中质子数和中子数相等,则X质子数是20,为Ca元素;
Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸,则Y为Cl元素,
通过以上分析知,X、Y两元素的名称分别是钙、氯,分别位于第四周期第IIA族、第三周期第VIIA族,
答:X、Y两元素的名称及在周期表中的位置分别是钙、氯、第四周期第IIA族、第三周期第VIIA族;
(2)解:X、Y通过得失电子形成离子化合物氯化钙,其形成过程为 ![]() ,
,
答:氯化钙的形成过程为 ![]()
【解析】0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子,X离子得电子被还原,电子的物质的量是1mol,二者的物质的量之比等于微粒个数之比,则每个X离子得到2个电子生成原子或单质;0.4gX的单质与足量盐酸充分反应放出0.02g氢气,则X是金属元素,其阳离子为二价阳离子,X与盐酸反应生成金属阳离子时,根据转移电子守恒得n(H2)=n(X),M(X)= ![]() =40g/mol,其相对原子质量为40,X中质子数和中子数相等,则X质子数是20,为Ca元素;Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸,则Y为Cl元素,再结合题目分析解答.
=40g/mol,其相对原子质量为40,X中质子数和中子数相等,则X质子数是20,为Ca元素;Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸,则Y为Cl元素,再结合题目分析解答.

【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | Ⅷ | ||||||
① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
② | ③ | ④ | ⑧ | ||||
⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题.
(1)化学性质最不活泼的元素的原子结构示意图为
(2)⑥④⑦的氢化物的稳定性最强的是:(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程: .
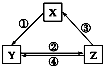
【题目】不能实现如图所示的变化的是( )
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
C | Na2CO3 | NaOH | NaHCO3 | ④过量Ca(OH)2溶液 |
D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
A.A
B.B
C.C
D.D