题目内容
【题目】原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36, Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。
回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y Z(填“大于”或“小于”),化合物HZY分子的空间构型为 。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是 ,该氢化物在水中的溶解性如何?主要原因是什么?
(3)元素Y 3个原子形成的单质分子与元素X、Y形成的一种离子互为等电子体,这种离子的化学式是 。
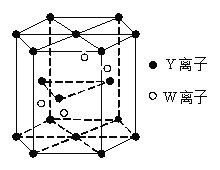
(4)基态W原子的电子排布式是 ,元素Y和W的一种化合物的晶体结构如右图所示,该晶体的化学式为 。(W处于晶体内部,Y分别处于晶胞面心、顶点、和内部)
(5)金属原子 (选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
【答案】(1)大于 V形
(2)5×6.02×1023 能与水分子间形成氢键,易溶于水
(3)NO2-
(4)1s22s22p63s23p63d54s1或[Ar]3d54s1Cr2O3
(5)镁
【解析】试题分析:原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,则Y为O元素;X、W基态原子是同周期元素中未成对电子数最多的原子,X原子序数比氧小则X在第二周期为N元素;则W为第三周期的P或第四周期的Cr;已知X与Z的原子核内质子数之和等于W原子核内质子数,若W为P,则Z为O,与Y相同,所以不符合题意,若W为Cr,则Z为Cl,而且Cl的基态原子只有1个未成对的电子;综上可知:X为N元素,Y为O元素,Z为Cl元素,W为Cr元素;
(1)已知化合物NCl3与H2O发生反应的化学方程式为NCl3+H2O→NH3+HClO,反应产物HClO中O元素为-2价,Cl元素为+1价,即O的得电子能力更强,所以电负性O大于Cl,HClO的结构为H-O-Cl,与H2O的H-O-H相似,是V形;
(2)N的一种氢化物常见的有NH3和N2H4,相对分子质量为32的是N2H4,其结构式为![]() ,分子中含有5个σ键,所以1mol该氢化物中的σ键数是5×6.02×1023;N2H4能与水分子间形成氢键,所以N2H4易溶于水;
,分子中含有5个σ键,所以1mol该氢化物中的σ键数是5×6.02×1023;N2H4能与水分子间形成氢键,所以N2H4易溶于水;
(3)元素O的一种单质分子与元素N、O形成的一种离子互为等电子体,已知O3和NO2-的原子数和价电子数相同互为等电子体,
(4)W为Cr元素,原子核外有24个电子,所以基态原子的电子排布式是;1s22s22p63s23p63d54s1,由图可知,晶胞内部含有4个Cr离子,O2-为:上下面12×2,顶点16×12,侧面12×6,所以共有6个,则Cr与O的离子数之比为2:3,所以该晶体的化学式为Cr2O3;
(5)由图可知,该晶胞为六方最密堆积,与Mg晶体的堆积方式相同。