题目内容
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1 mol/L,下列说法正确的是( )
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL0.lmol/L盐酸后,pH最大的是① |
| D.若用Pt电极电解3种溶液一段时间后,pH均不变 |
C
解析试题分析:A.③NaOH是碱电离使溶液显碱性。而①Na2CO3②CH3COONa是盐水解使溶液显碱性,盐水解的程度是很微弱的,而且规律是越弱越水解。由于酸性CH3COOH>H2CO3。所以等浓度是溶液的碱性Na2CO3>CH3COON所以3种溶液pH的大小顺序是③>①>②。错误。B.若将3种溶液稀释相同倍数,由于碱完全电离,稀释使OH-的浓度减小;而强碱弱酸盐在溶液中存在水解平衡,稀释使盐水解的沉淀增大,因此溶液的碱性变化相对较小。因此pH变化最大的是③。错误。C.若分别加入25mL0.lmol/L盐酸后,①Na2CO3恰好发生反应:Na2CO3+ HCl="NaCl+" NaHCO3。得到的溶液含有强碱弱酸盐,仍然是碱性;②CH3COONa恰好发生反应CH3COONa+HCl=CH3COOH+NaCl。CH3COOH电离是溶液显酸性;③恰好发生反应:NaOH+HCl= H2O +NaCl。溶液为中性。因此pH最大的是①。正确。D.若用Pt电极电解3种溶液由于实质都是电解水,所以一段时间后,物质的浓度均增大,溶液pH均变大。错误。
考点:考查Na2CO3溶液 、CH3COONa溶液、NaOH溶液的pH、溶液稀释及电解时变化的知识。

 名校课堂系列答案
名校课堂系列答案下列说法不正确的是
| A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体 |
| C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D.室温下,c(NH4+)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3) |
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.Ka(HF) |
| C.c(F-)/c(H+) | D.c(H+)/c(HF) |
W、X、Y、Z是原子序数依次增大的四种短周期元素,化合物WX能抑制水的电离。化合物Y2Z能促进水的电离,则Y元素是
| A.Na | B.F | C.Li | D.Cl |
有关AgCl的沉淀溶解平衡的说法正确的是
| A.AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.用等体积的蒸馏水和0.01mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失小于用稀盐酸洗涤的损失量。 |
| D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
物质的量浓度相同的下列溶液中,含离子和分子种类最多的是
| A.CaCl2 | B.CH3COONa |
| C.氨水 | D.K2S |
下列有关物质浓度关系的描述,正确的是
| A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(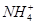 )>c( )>c(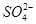 )>c(OH-)=c(H+) )>c(OH-)=c(H+) |
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c( )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度: |
 =10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )