题目内容
X、Y、Z、R、W五种元素分布在三个不同的短周期,它们的原子序数依次增大.YR2是主要的温室气体,W是短周期中金属性最强的元素.甲是W的最高价氧化物的水化物,乙是X、Z组成的最简单化合物.(1)Z元素在周期表中位于第2周期,第 族.
(2)甲含有的化学键有 .
(3)比较Y、R、W原子半径的大小: < < .
(4)一定条件下,X单质和R单质在甲的浓溶液中可以形成燃料电池,该燃料电池的正极的反应式是 .
(5)工业上生产乙的适宜的反应条件是 和较高的温度;若每生成a mol乙时放出b kJ热量,则该反应的热化学方程式为 .
(6)丙、丁、戊三种化合物都只由X、Y、R三种元素组成,在一定条件下有以下转化关系:

若戊是日常生活中常用的酸性调味品,则以上丙生成丁的化学方程式为: .
【答案】分析:YR2是主要的温室气体,应为CO2,则Y为C元素,R为O元素,Y、Z、R原子序数依次增大,则Z为N元素,W是短周期中金属性最强的元素,应为Na元素,X、Y、Z、R、W五种元素分布在三个不同的短周期,则X应为第一周期元素H,甲是W的最高价氧化物的水化物,应为NaOH,乙是X、Z组成的最简单化合物,应为NH3,根据元素对应单质、化合物的结构和性质结合元素周期律知识解答该题.
解答:解:YR2是主要的温室气体,应为CO2,则Y为C元素,R为O元素,Y、Z、R原子序数依次增大,则Z为N元素,W是短周期中金属性最强的元素,应为Na元素,X、Y、Z、R、W五种元素分布在三个不同的短周期,则X应为第一周期元素H,甲是W的最高价氧化物的水化物,应为NaOH,乙是X、Z组成的最简单化合物,应为NH3,则
(1)Z为N元素,原子序数为7,原子核外有2个电子层,最外层电子数为5,位于周期表第二周期VA族,故答案为:VA;
(2)甲为NaOH,为离子化合物,含有离子键,NaOH中O-H为共价键,故答案为:离子键、共价键;
(3)O和C位于同一周期,C原子半径大于O,Na位于第三周期,比O、C多了一个电子层,原子半径最大,所以三者原子半径大小关系为:Na>C>O,故答案为:O、C、Na;
(4)碱性氢氧燃料电池中,氧气在正极发生还原反应生成OH-,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(5)工业合成氨在高温、高压、催化剂条件下进行,若每生成a molNH3时放出b kJ热量,则生成1molNH3放出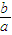 kJ的能量,所以合成氨的热化学方程式为N2(g)+3H2(g)
kJ的能量,所以合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g)△H=-
2NH3(g)△H=-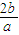 kJ?mol-1,
kJ?mol-1,
故答案为:合适的催化剂,高压;N2(g)+3H2(g) 2NH3(g)△H=-
2NH3(g)△H=-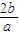 kJ?mol-1;
kJ?mol-1;
(6)戊是日常生活中常用的酸性调味品,应为CH3COOH,则丙为CH3CH2OH,丁为CH3CHO,丙生成丁的反应为2CH3CH2OH+O2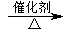 2CH3CHO+2H2O,
2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2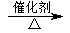 2CH3CHO+2H2O.
2CH3CHO+2H2O.
点评:本题考查较为综合,涉及元素的推断和有机物的推断,题目难度中等,本题注意把握常见物质的结构、性质和用途.
解答:解:YR2是主要的温室气体,应为CO2,则Y为C元素,R为O元素,Y、Z、R原子序数依次增大,则Z为N元素,W是短周期中金属性最强的元素,应为Na元素,X、Y、Z、R、W五种元素分布在三个不同的短周期,则X应为第一周期元素H,甲是W的最高价氧化物的水化物,应为NaOH,乙是X、Z组成的最简单化合物,应为NH3,则
(1)Z为N元素,原子序数为7,原子核外有2个电子层,最外层电子数为5,位于周期表第二周期VA族,故答案为:VA;
(2)甲为NaOH,为离子化合物,含有离子键,NaOH中O-H为共价键,故答案为:离子键、共价键;
(3)O和C位于同一周期,C原子半径大于O,Na位于第三周期,比O、C多了一个电子层,原子半径最大,所以三者原子半径大小关系为:Na>C>O,故答案为:O、C、Na;
(4)碱性氢氧燃料电池中,氧气在正极发生还原反应生成OH-,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(5)工业合成氨在高温、高压、催化剂条件下进行,若每生成a molNH3时放出b kJ热量,则生成1molNH3放出
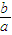 kJ的能量,所以合成氨的热化学方程式为N2(g)+3H2(g)
kJ的能量,所以合成氨的热化学方程式为N2(g)+3H2(g)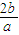 kJ?mol-1,
kJ?mol-1,故答案为:合适的催化剂,高压;N2(g)+3H2(g)
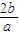 kJ?mol-1;
kJ?mol-1;(6)戊是日常生活中常用的酸性调味品,应为CH3COOH,则丙为CH3CH2OH,丁为CH3CHO,丙生成丁的反应为2CH3CH2OH+O2
故答案为:2CH3CH2OH+O2
点评:本题考查较为综合,涉及元素的推断和有机物的推断,题目难度中等,本题注意把握常见物质的结构、性质和用途.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素.原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等.下列说法正确的是( )
| A、Y与Z形成的离子化合物中只能有离子键 | B、Y、Z、R的简单离子半径:Y<R<Z | C、Y、W的氢化物的沸点:Y>W | D、X在分别与Z和W形成的化合物中的化合价相同 |
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素。原子半径X<Y< W< R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等。下列说法不正确的是( )
| A.Y、Z、R的简单离子具有相同的电子层结构 |
| B.X2Y分子间存在氢键,故X2Y比X2W稳定 |
| C.X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性 |
| D.由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生反应 |
 2NH3(g)△H=-2b/akJ?mol-1
2NH3(g)△H=-2b/akJ?mol-1
 2CH3CHO+2H2O
2CH3CHO+2H2O