题目内容
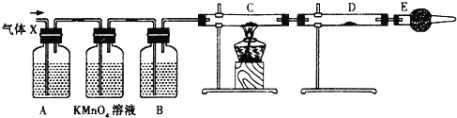
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去)。注:C中为氧化铜粉末。
(1)实验室制备二氧化硫的化学方程式为:________________________________;
(2)乙同学认为产生氢气的理由是:______________________;
(3)B中试剂是______,D中试剂是______;(填名称)
(4)E装置的作用是_________________________;
(5)可以证明气体X中含有氢气的实验现象是:____________________________
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2 浓硫酸 无水硫酸铜 防止空气中的水蒸气进入D中 C中黑色的CuO变成红色的Cu,D中白色粉末变成蓝色
【解析】
(1)实验室用Na2SO和H2SO反应制二氧化硫气体。
(2)反应时浓硫酸浓度逐渐变稀,锌与稀硫酸反应可产生氢气。
(3)B中试剂是浓硫酸,作用是除去水蒸气,D中试剂是无水硫酸铜,检验水的生成。
(4)E装置的作用是防止空气中的水蒸气进入D中。
(5)证明气体X中含有氢气的现象为C中黑色的CuO变成红色的Cu,D中白色粉末变成蓝色。
(1)实验室制备二氧化硫的化学方程式为:Na2SO+H2SO=Na2SO+SO↑+H2O,故答案为:Na2SO+H2SO=Na2SO+SO↑+H2O。
(2)反应时浓硫酸浓度逐渐变稀,锌与稀硫酸反应可产生氢气,故答案为:浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2。
(3)B中试剂是浓硫酸,作用是除去水蒸气,D中试剂是无水硫酸铜,作用是检验水的生成,故答案为:浓硫酸;无水硫酸铜。
(4)E装置的作用是防止空气中的水蒸气进入D中,以免对实验产生干扰,故答案为:防止空气中的水蒸气进入D中。
(5)证明气体X中含有氢气的现象为C中黑色的CuO变成红色的Cu,D中白色粉末变成蓝色,故答案为:C中黑色的CuO变成红色的Cu,D中白色粉末变成蓝色。