题目内容
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
|
t / s |
0 |
50 |
150 |
250 |
350 |
|
n(PCl3) mol |
0 |
0. 16 |
0. 19 |
0. 20 |
0. 20 |
下列说法正确的是
A.反应在前50 s 的平均速率v(PCl3)= 0. 0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的△H < 0
C.相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前v(正) > v(逆)
D.相同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的转化率小于80%
C
【解析】
试题分析:反应在前50 s 的平均速率v(PCl3)= 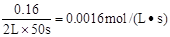 ,选项A不正确;平衡时c(PCl3)="
0." 10 mol·L-1,若保持其他条件不变,升高温度,平衡时c(PCl3)="
0." 11 mol·L-1,则说明升高温度,平衡向正反应方向进行,即正反应是放热反应,选项B不正确;根据平衡时c(PCl3)=" 0." 10 mol·L-1可知,平衡时PCl5和氯气的浓度分别是0.4mol/L和0.1mol/L,所以该反应的平衡常数K=
,选项A不正确;平衡时c(PCl3)="
0." 10 mol·L-1,若保持其他条件不变,升高温度,平衡时c(PCl3)="
0." 11 mol·L-1,则说明升高温度,平衡向正反应方向进行,即正反应是放热反应,选项B不正确;根据平衡时c(PCl3)=" 0." 10 mol·L-1可知,平衡时PCl5和氯气的浓度分别是0.4mol/L和0.1mol/L,所以该反应的平衡常数K=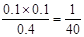 。选项C中此时
。选项C中此时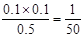 <1/40,所以反应向正反应方向进行,即反应达到平衡前v(正)>v(逆),选项C正确;2. 0 mol PCl3和2. 0 mol Cl2就相当于是2molPCl5。由于正反应是体积增大的,所以此时和原平衡相比,相当于是增大压强,平衡向逆反应方向进行,因此 PCl3的物质的量小于0.4mol,则达到平衡时,PCl3的转化率大于于80%,选项D不正确,答案选C。
<1/40,所以反应向正反应方向进行,即反应达到平衡前v(正)>v(逆),选项C正确;2. 0 mol PCl3和2. 0 mol Cl2就相当于是2molPCl5。由于正反应是体积增大的,所以此时和原平衡相比,相当于是增大压强,平衡向逆反应方向进行,因此 PCl3的物质的量小于0.4mol,则达到平衡时,PCl3的转化率大于于80%,选项D不正确,答案选C。
考点:化学平衡
点评:本题综合性较强,难度较大,需要用等效平衡解决问题。

温度为T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测得部分数据见下表:
下列说法正确的是 ( )
| A.反应在前50 s 的平均速率v (PCl3) =" 0." 0032 mol·L-1·s-1 |
| B.其他条件不变,升高温度,达新平衡时c (PCl3) =" 0." 11 mol·L-1 ,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入2. 0 mol PCl3和2. 0 mol Cl2 ,达到平衡时,PCl3 的转化率小于80% |
| D.相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3和0. 20 mol Cl2 ,反应达到平衡前v(正) > v(逆) |
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) →PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
|
t/s |
0 |
50 |
150 |
250 |
350 |
|
n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前50 s内的平均速率v(PCl3)=0.0032 mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,该反应为放热反应
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入 2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应
PCl5(g)  PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
|
t / s |
0 |
50 |
150 |
250 |
350 |
|
n(PCl3) / mol |
0 |
0. 16 |
0. 19 |
0. 20 |
0. 20 |
下列说法正确的是
A. 反应在前50 s 的平均速率v(PCl3)= 0. 0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的H<0
C. 相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的转化率小于80%

