题目内容
某化学反应 3 A  2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
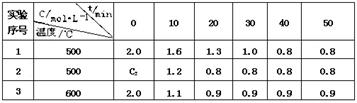
根据上述数据,完成下列填空:
(1)在实验 1 ,反应在10 min ~20 min 内平均速率为_______ mol /(L·min)
(2)在实验 2 ,A 的初始浓度 C2 _______ mol / L ,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是____________________________
(3)比较实验3和实验 1,可推测正反应是______反应(填吸热或放热)。理由是____
 2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验 1 ,反应在10 min ~20 min 内平均速率为_______ mol /(L·min)
(2)在实验 2 ,A 的初始浓度 C2 _______ mol / L ,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是____________________________
(3)比较实验3和实验 1,可推测正反应是______反应(填吸热或放热)。理由是____
1)0.03 mol /(L·min)
(2)2.0mol / L ,催化剂
(3)放热反应,理由是升高温度平衡向逆向移动,所以正反应是放热反应
(2)2.0mol / L ,催化剂
(3)放热反应,理由是升高温度平衡向逆向移动,所以正反应是放热反应
试题分析:(1)中,在实验 1 ,反应在10 min ~20 min 内平均速率为
(1.6-1.3)/10 mol /(L·min)="0.03" mol /(L·min);(2)中,在实验 2 ,A 的初始浓度为2.0mol / L ,因为刚开始生成物都为0,催化剂能够缩短达到平衡的时间,所以实验 2 中还隐含的条件是催化剂;(3)中,温度升高,A的含量增大,说明了平衡向左移动,由此可以知道正反应是放热反应,理由是升高温度平衡向逆向移动,所以正反应是放热反应。
点评:本题考查了化学反应速率,平衡的移动,是高考的常考题型,本题比较基础,学生很容易得高分。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
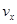 ,(x代表某反应物或生成物)之间的关系,正确的是( )
,(x代表某反应物或生成物)之间的关系,正确的是( ) 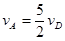
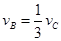
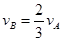
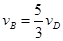
 2C(g)+2D(g),在不同条件下的反应速率分别为:
2C(g)+2D(g),在不同条件下的反应速率分别为: 4NO(g)+6H2O(g)在5 L密闭容器中进行,10s后H2O的物质的量增加了0.60 mol,则10s内反应的平均速率
4NO(g)+6H2O(g)在5 L密闭容器中进行,10s后H2O的物质的量增加了0.60 mol,则10s内反应的平均速率 (X)可表示为 ( )
(X)可表示为 ( ) 4NO2(g)+ O2(g)。
4NO2(g)+ O2(g)。 3C(g)+4D(g),下列情况能够降低该反应速率的是( )
3C(g)+4D(g),下列情况能够降低该反应速率的是( ) 2C(g),下列各数据表示不同条件下的反应速率,
2C(g),下列各数据表示不同条件下的反应速率,