题目内容
反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,其物质间转化关系如图1所示,虚框内是需设计的内容,反应物只能用A~N中的物质.请回答下列问题: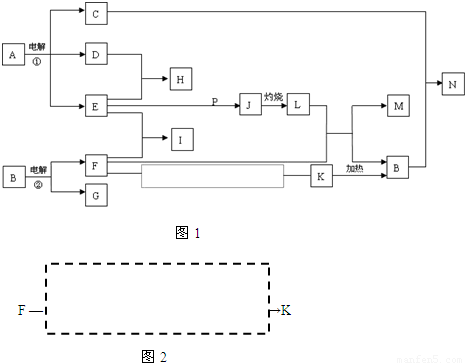
(1)电解池①中的阴极产物的名称______
(2)足量的E与P溶液反应生成J,离子方程式为______
(3)N溶液呈碱性,用离子方程式解释原因______
(4)请模仿上述物质转化关系图(见图2)设计F→K的最佳途径:(用A~N中的物质的化学式表示)
按设计得到1molK,至少需要另加的试剂及其物质的量是n______=______mol;n______=______mol.
【答案】分析:反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,说明含钠元素,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,依据题干信息分析判断,反应①是电极饱和食盐水的 反应生成的有色气体E是Cl2,H为气体为HCl,D为H2;C为NaOH;G是空气中主要成分之一,F、M是生活中常见的金属,K白色沉淀加热得到B说明为氧化物,所以反应②是电解Al2O3的反应生成F为Al,G为O2,I为AlCl3;推断B为Al2O3,K为Al(OH)3,C+B=N是NaOH和Al2O3反应生成NaAlO2的反应,F为Al、M为Fe是生活中常见的金属,P是M和紫黑色固体单质为I2,化合的产物推断P为FeI2,2Cl2+2FeI2=2FeCl3+2I2,判断J为FeCl3,灼烧得到Fe2O3,M为Fe符合转化关系;F-K的转化是Al和盐酸反应生成氯化铝,和氢氧化钠反应生成偏铝酸钠溶液,氯化铝和偏铝酸钠溶液混合生成氢氧化铝沉淀,依据推断分析判断回答.
解答:解:反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,说明含钠元素,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,依据题干信息分析判断,反应①是电极饱和食盐水的 反应生成的有色气体E是Cl2,H为气体为HCl,D为H2;C为NaOH;G是空气中主要成分之一,F、M是生活中常见的金属,K白色沉淀加热得到B说明为氧化物,所以反应②是电解Al2O3的反应生成F为Al,G为O2,I为AlCl3;推断B为Al2O3,K为Al(OH)3,C+B=N是NaOH和Al2O3反应生成NaAlO2的反应,F为Al、M为Fe是生活中常见的金属,P是M和紫黑色固体单质为I2,化合的产物推断P为FeI2,2Cl2+2FeI2=2FeCl3+2I2,判断J为FeCl3,灼烧得到Fe2O3,M为Fe符合转化关系;F-K的转化是Al和盐酸反应生成氯化铝,和氢氧化钠反应生成偏铝酸钠溶液,氯化铝和偏铝酸钠溶液混合生成氢氧化铝沉淀;
(1)依据分析判断得到电解池①中的阴极产物的名称为氢氧化钠、氢气,故答案为:氢氧化钠、氢气;
(2)足量的E为Cl2与P为FeI2溶液发生氧化还原反应,反应生成J为FeCl3,反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;
(3)N为NaAlO2溶液,呈碱性是因为偏铝酸根离子水解生成氢氧化铝和氢氧根离子,反应的离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,
故答案为:AlO2-+2H2O?Al(OH)3+OH-;
(4)F→K的最佳途径是铝和盐酸反应生成氯化铝,铝和氢氧化钠溶液反应生成偏铝酸钠,氯化铝和偏铝酸钠溶液混合发生双水解反应,
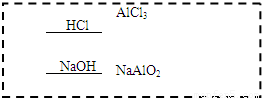
按设计得到1molK,至少需要另加的试剂及其物质的量依据反应化学方程式计算得到,2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl;生成1molAl(OH)3,需要0.25molAlCl3+和0.75molNaAlO2,依据铝和酸和碱反应的化学方程式得到:n(HCl)=0.75mol; n(NaOH)=0.75mol.
故答案为:(HCl);0.75;(NaOH);0.75.
点评:本题考查了物质装箱的分析判断,物质性质和转化反应现象的分析是解题关键,主要是铝及其化合物性质的应用,电解饱和食盐水的氯碱工业,电解氧化铝的工业制备铝生产工业过程分析推断是解题关键,题目难度较大.
解答:解:反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,说明含钠元素,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,依据题干信息分析判断,反应①是电极饱和食盐水的 反应生成的有色气体E是Cl2,H为气体为HCl,D为H2;C为NaOH;G是空气中主要成分之一,F、M是生活中常见的金属,K白色沉淀加热得到B说明为氧化物,所以反应②是电解Al2O3的反应生成F为Al,G为O2,I为AlCl3;推断B为Al2O3,K为Al(OH)3,C+B=N是NaOH和Al2O3反应生成NaAlO2的反应,F为Al、M为Fe是生活中常见的金属,P是M和紫黑色固体单质为I2,化合的产物推断P为FeI2,2Cl2+2FeI2=2FeCl3+2I2,判断J为FeCl3,灼烧得到Fe2O3,M为Fe符合转化关系;F-K的转化是Al和盐酸反应生成氯化铝,和氢氧化钠反应生成偏铝酸钠溶液,氯化铝和偏铝酸钠溶液混合生成氢氧化铝沉淀;
(1)依据分析判断得到电解池①中的阴极产物的名称为氢氧化钠、氢气,故答案为:氢氧化钠、氢气;
(2)足量的E为Cl2与P为FeI2溶液发生氧化还原反应,反应生成J为FeCl3,反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;
(3)N为NaAlO2溶液,呈碱性是因为偏铝酸根离子水解生成氢氧化铝和氢氧根离子,反应的离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,
故答案为:AlO2-+2H2O?Al(OH)3+OH-;
(4)F→K的最佳途径是铝和盐酸反应生成氯化铝,铝和氢氧化钠溶液反应生成偏铝酸钠,氯化铝和偏铝酸钠溶液混合发生双水解反应,
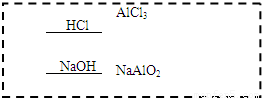
按设计得到1molK,至少需要另加的试剂及其物质的量依据反应化学方程式计算得到,2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl;生成1molAl(OH)3,需要0.25molAlCl3+和0.75molNaAlO2,依据铝和酸和碱反应的化学方程式得到:n(HCl)=0.75mol; n(NaOH)=0.75mol.
故答案为:(HCl);0.75;(NaOH);0.75.
点评:本题考查了物质装箱的分析判断,物质性质和转化反应现象的分析是解题关键,主要是铝及其化合物性质的应用,电解饱和食盐水的氯碱工业,电解氧化铝的工业制备铝生产工业过程分析推断是解题关键,题目难度较大.

练习册系列答案
相关题目