题目内容
【题目】Ⅰ.已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去) ,请回答下列问题:
(1)请写出F的化学式 ;在②反应中,当生成2.24L的G(标准状况)时,反应中转移的电子的物质的量为 moL。
(2)若A、C、D均含有氯元素,且A中的化合价介于C与D之间,写出反应①的离子方程式: 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B分别为 、 。(写化学式)
(4)若A与B均为固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,反应①是实验室制备D的反应,则反应①的化学方程式为 。
Ⅱ.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应产物略去)。
![]()
(1)若A是一种黄色非金属单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的电子式为 ,写出C和CO2反应的化学方程式,并标出单线桥 。
(3)若A是碱性气体,试写出A与氧气反应的化学方程式 。
【答案】Ⅰ.(1)Na2O2 0.2
(2)Cl2+2OH-=Cl-+ClO-+H2O(3)C、浓H2SO4
(4)2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑(2分)
CaCl2+2H2O+2NH3↑(2分)
Ⅱ.(1)2SO2+O2![]() 2SO3
2SO3
(2)![]()
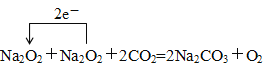
(3)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】
试题分析:Ⅰ.已知常温下E为无色无味的液体,则E是水。F为淡黄色粉末,能与E反应,说明F是过氧化钠。G为常见的无色气体(反应条件均已略去) ,因此G是氧气,H是氢氧化钠。
(1)F的化学式为Na2O2;过氧化钠中氧元素的化合价是-1价,反应转化为氧气中的0价,所以在②反应中,当生成2.24L的G(标准状况)即0.1mol氧气时,反应中转移的电子的物质的量为0.2moL。
(2)若A、C、D均含有氯元素,且A中的化合价介于C与D之间,这说明该反应是氯气与碱溶液的反应,则反应①的离子方程式为Cl2+2OH-=Cl- + ClO- +H2O。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则分别是CO2和SO2,因此A与B分别为C、浓H2SO4。
(4)若A与B均为固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,该气体是氨气,实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2 +2H2O+2NH3↑。
CaCl2 +2H2O+2NH3↑。
Ⅱ.(1)若A是一种黄色非金属单质固体,则A是S,所以B是SO2,C是三氧化硫,因此B→C的化学方程式为2SO2+O2![]() 2SO3。
2SO3。
(2)若A是一种活泼金属,C是淡黄色固体,则A是Na,B是氧化钠,C是过氧化钠,所以C的电子式为![]() ,过氧化钠和CO2反应的化学方程式为
,过氧化钠和CO2反应的化学方程式为
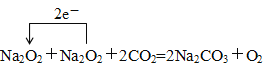 。
。
(3)若A是碱性气体,因此A是氨气,所以B是NO,C是NO2,则A与氧气反应的化学方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。

 全能练考卷系列答案
全能练考卷系列答案