题目内容
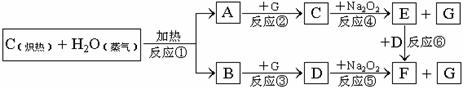
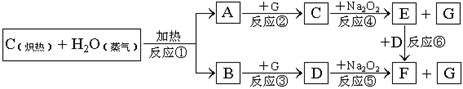
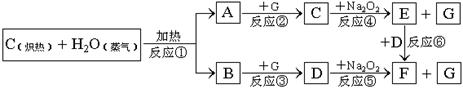
根据下面物质间转换的框图,回答有关问题:
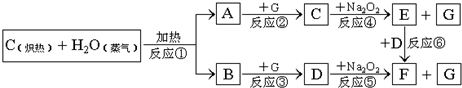
(1)由反应①产生的A、B混合物的工业名称是
(2)写出框图中D、E的电子式:D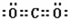
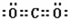 ;E
;E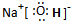
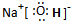
(3)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是多少
(4)请设计一个课堂小实验,证实反应⑤是放热反应.
(5)如果A、B混合气体7.8g(平均摩尔质量10g?mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重

(1)由反应①产生的A、B混合物的工业名称是
水煤气
水煤气
.(2)写出框图中D、E的电子式:D
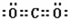
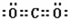
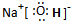
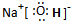
(3)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是多少
22.4
22.4
L,同时反应中转移电子总数是2NA
2NA
.(NA表示阿佛加德罗常数)(4)请设计一个课堂小实验,证实反应⑤是放热反应.
(5)如果A、B混合气体7.8g(平均摩尔质量10g?mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重
7.8
7.8
g,并得到O20.39
0.39
mol.分析:C和水蒸气反应生成一氧化碳和氢气,由C+Na2O2→E+G,D+Na2O2→F+G,故G为O2,一氧化碳和氧气反应生成二氧化碳,氢气和氧气反应生成水,二氧化碳和过氧化钠反应生成碳酸钠和氧气,水和过氧化钠反应生成氢氧化钠和氧气,E
F,所以NaOH,D是CO2,F是Na2CO3,C是H2O.
| D |
解答:解:C和水蒸气反应生成一氧化碳和氢气,由C+Na2O2→E+G,D+Na2O2→F+G,故G为O2,一氧化碳和氧气反应生成二氧化碳,氢气和氧气反应生成水,二氧化碳和过氧化钠反应生成碳酸钠和氧气,水和过氧化钠反应生成氢氧化钠和氧气,E
F,所以NaOH,D是CO2,F是Na2CO3,C是H2O,
(1)高温条件下,碳和水反应生成一氧化碳和氢气,混合物的工业名称是水煤气,故答案为:水煤气;
(2)通过以上分析知,D是二氧化碳,E是氢氧化钠,其电子式分别是: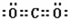 ,
,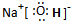 ,故答案为:
,故答案为: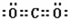 ;
;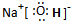 ;
;
(3)设生成气体的体积是x,转移电子数是y.
2Na2O2+2H2O=4NaOH+O2 ↑转移电子
2mol 22.4L 2mol
2mol x y
x=22.4L
y=2NA
故答案为:22.4L;2NA;
(4)将棉花包裹过氧化钠,放入充满二氧化碳的集气瓶中,如果棉花燃烧就证明是放热反应,否则是吸热反应;
故答案为:Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应(直接通CO2于被棉花包裹Na2O2也可,其它合理答案也给分);
(5)一氧化碳、氢气与氧气反应生成二氧化碳、水,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,过氧化钠增重等于CO与H2的质量,故过氧化钠增重7.8g;
设混合物中一氧化碳的物质的量是n1,氢气的物质的量是n2,
M=
=10,整理的n1:n2=4:9,由二者质量有28n1+2n2=7.8,联立解得n1=0.24,n2=0.54,
根据元素守恒CO、H2与O2反应后生成0.24molCO2,0.54molH2O,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,生成氧气的体积为
×0.24mol+
×0.54mol=0.39mol;
故答案为:7.8;0.39.
| D |
(1)高温条件下,碳和水反应生成一氧化碳和氢气,混合物的工业名称是水煤气,故答案为:水煤气;
(2)通过以上分析知,D是二氧化碳,E是氢氧化钠,其电子式分别是:
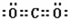 ,
,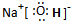 ,故答案为:
,故答案为: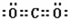 ;
;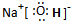 ;
;(3)设生成气体的体积是x,转移电子数是y.
2Na2O2+2H2O=4NaOH+O2 ↑转移电子
2mol 22.4L 2mol
2mol x y
x=22.4L
y=2NA
故答案为:22.4L;2NA;
(4)将棉花包裹过氧化钠,放入充满二氧化碳的集气瓶中,如果棉花燃烧就证明是放热反应,否则是吸热反应;
故答案为:Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应(直接通CO2于被棉花包裹Na2O2也可,其它合理答案也给分);
(5)一氧化碳、氢气与氧气反应生成二氧化碳、水,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,过氧化钠增重等于CO与H2的质量,故过氧化钠增重7.8g;
设混合物中一氧化碳的物质的量是n1,氢气的物质的量是n2,
M=
| 28n1+2n2 |
| n1+n2 |
根据元素守恒CO、H2与O2反应后生成0.24molCO2,0.54molH2O,由2Na2O2+2H2O=4NaOH+O2 ,2Na2O2+2CO2=2Na2CO3+O2 可知,生成氧气的体积为
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:7.8;0.39.
点评:本题以无机框图题的形式考查C、Na等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写能力、化学计算等,难度中等,注意(5)中氧气的物质的量可以利用方程式观察,结合元素守恒,氧气的物质的量为一氧化碳、氢气混合气体的一半.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
 ;E
;E  。(NA表示阿佛加德罗常数)
。(NA表示阿佛加德罗常数) ol。
ol。