��Ŀ����
����Ŀ����ҵ�ϳ��÷�¯��(��Ҫ��FeO��V2O5����������SiO2��P2O5������)��ȡV2O5���������£�
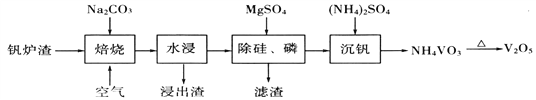
��1�����յ�Ŀ���ǽ�FeO��V2O3ת��Ϊ������NaVO3���ù����б�������Ԫ����_______________������������Ҫ�ɷ�Ϊ____________________(�ѧʽ)��
��2����MgSO4��Һ���衢��ʱ����������Ҫ�ɷ�Ϊ__________��
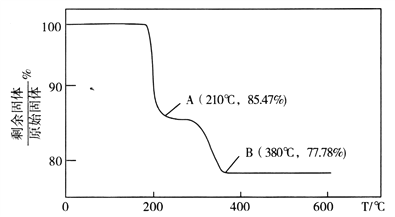
��3���ڱ���NH4VO3�Ĺ����У����������ļ���ֵ(������)���¶ȱ仯��������ͼ��ʾ��210��ʱ��ʣ��������ʵĻ�ѧʽΪ_____________________��
��4����V2O5ұ���������������ȷ����������ȷ�Ӧ��ʵ�������__________________.
��5����V2O5��������ϡ����õ�250mL(VO2)2SO4��Һ��ȡ25.00mL����Һ����ƿ�У���0.1000 mol��L-1H2C2O4����Һ���еζ����ﵽ�ζ��յ�ʱ���ı���Һ�����Ϊ20.00mL����֪�ζ�������H2C2O4������ΪCO2��VO2+(��ɫ)����ԭΪVO2+(��ɫ)��
�ٸõζ�ʵ�鲻��Ҫ�������ָʾ�����ﵽ�ζ��յ��������___________________��
��(VO2)2SO4��Һ�����ʵ����ʵ���Ũ��Ϊ___________________��
�۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ�����ʹ���_________(����ƫ��������ƫ����������Ӱ����)��
���𰸡� Fe��V Fe2O3 MgSiO3��Mg3(PO4)2 HVO3 �����ȼ��Ϸ���һ��KClO3������þ������ȼ ��Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ� 0.08mol/L ƫ��
����������¯��(��Ҫ��FeO��V2O5����������SiO2��P2O5������)������̼����ͨ��������գ�����ˮ�����˵õ�������Ҫ������������Һ�м�������þ��ȥ�衢�ף����ˣ���������Ҫ�ɷ�ΪMgSiO3��Mg3(PO4)2����Һ�м�������麟�������NH4VO3�����ȷֽ�����V2O5��
��1�����յ�Ŀ���ǽ�FeOV2O3ת��Ϊ������NaVO3���������Ͷ�����̼����Ӧ��Fe��VԪ�صĻ��ϼ����ߣ���˸ù����б�������Ԫ����Fe��V����ת��Ϊ�����������Խ���������Ҫ�ɷ�ΪFe2O3����Ϊ��Fe��V��Fe2O3
��2���������Ϸ�����֪��MgSO4��Һ���衢��ʱ��������Ҫ�ɷ�ΪMgSiO3��Mg3(PO4)2��Ϊ��MgSiO3��Mg3(PO4)2
��3��NH4VO3�ֽ�Ĺ��������ɰ�����HVO3��HVO3��һ���ֽ�����V2O5��210��ʱ���ֽ�������Ͱ�������ʣ�����ռ��ʼ����ٷֺ���Ϊ100/117��100%=85.47%������210��ʱ��ʣ��������ʵĻ�ѧʽΪ��HVO3����Ϊ��HVO3
��4���������ȷ�Ӧ��ʵ������������ȼ��Ϸ���һ��KClO3������þ������ȼ����Ϊ�������ȼ��Ϸ���һ��KClO3������þ������ȼ
��5������֪�ζ�������H2C2O4������ΪCO2��VO2+(��ɫ)����ԭΪVO2+(��ɫ)�����Ըõζ�ʵ�鲻��Ҫ�������ָʾ�����ﵽ�ζ��յ����������Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ����ڷ�Ӧ��VԪ�ػ��ϼ۴�+5�۽��͵�+4�ۣ��õ�1�����ӣ�̼Ԫ�ػ��ϼ۴�+3�����ߵ�+4�ۣ�ʧȥ1�����ӣ�����ݵ��ӵ�ʧ�غ��֪�μӷ�Ӧ��(VO2)2SO4�����ʵ������ڲ�������ʵ�������Ϊ0.1mol/L��0.02L����(VO2)2SO4��Һ�����ʵ����ʵ���Ũ��Ϊ![]() ���۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ����������ƫС�����ı�Һ������٣���˽�ʹ���ƫ�͡���Ϊ������Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ���0.08mol/L��ƫ��
���۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ����������ƫС�����ı�Һ������٣���˽�ʹ���ƫ�͡���Ϊ������Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ���0.08mol/L��ƫ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | K=1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | K1=1.5��10��2 K2=1.02��10��7 |
(1)��д��H2SO3�ĵ���ƽ�ⳣ��K1�ı���ʽ��________________��
(2) �����£������Ϊ10mL pH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��_____���ߣ����������������=������
(3)һ�������£��������ˮϡ��������Һ��������I���ˮ���V�仯��������ͼ��ʾ����a��b��c������Һ����ĵ���̶��ɴ�СΪ____________________��

(4)��������CH3COO����CO32����HSO3����SO32������Һ�н��H���������ɴ�С�Ĺ�ϵΪ___________��
(5)�����ͬ��c(H��)��ͬ�Ģ�CH3COOH����HCl����H2SO4 ��������Һ�ֱ���ͬŨ�ȵ�NaOH��Һ��ȫ�к�ʱ������NaOH��Һ������ɴ�С������˳����_____(�����)��
(6)��֪��H��(aq) + OH��(aq) == H2O(l) ��H =��57.3 kJ/mol��ʵ����ϡ������ϡNaOH��Һ��Ӧ����1 mol H2Oʱ�ų�57 kJ���ȣ��������Һ�У����������Ȼ�ѧ����ʽΪ________________��