��Ŀ����
����Ŀ��NO��CO�ڽ�����(Rh)�Ĵ��·�����Ӧ2NO(g)��CO(g)=N2O(g)��CO2(g)����H���÷�Ӧ���̾�������������
��Ӧ��NO(g)��CO(g)��Rh(s)=RhN(s)��CO2(g) ����H1����33.44 kJ��mol��1��
��Ӧ��RhN(s)��NO(g)=Rh(s)��N2O����H2����319.35 kJ��mol��1��
��ͼ��ʾΪ�÷�Ӧ������(a)���д���(b)ʱ��Ӧ���̵������仯�Ա�ͼ��

�����й��ж���ȷ����(����)
A.��H����285.91 kJ��mol��1
B.E1Ϊ��Ӧ2NO(g)��CO(g)=N2O(g)��CO2(g)�Ļ��
C.E2Ϊʹ�ô����͵Ļ��
D.ʹ�ú��ʵĴ����ɽ��ͷ�Ӧ�Ļ�ܣ���߷�Ӧ����
���𰸡�D
��������
A����Ӧ��NO(g)��CO(g)��Rh(s)=RhN(s)��CO2(g) ����H1����33.44 kJ��mol��1����Ӧ��RhN(s)��NO(g)=Rh(s)��N2O����H2����319.35 kJ��mol��1�����ݸ�˹���ɣ�����ӦI+��Ӧ��ã�2NO(g)��CO(g)=N2O(g)��CO2(g) ��H��(��33.44 kJ��mol��1)+(��319.35 kJ��mol��1)=��352.79 kJ��mol��1����A����
B������ͼ��E1Ϊ��Ӧ2NO(g)��CO(g)=N2O(g)��CO2(g)�д���������ʱ�Ļ�ܵIJ��B����
C������ͼ��E2Ϊ�÷�Ӧ�ķ�Ӧ�ȣ���C����
D��ʹ�ú��ʵĴ����ɽ��ͷ�Ӧ�Ļ�ܣ��������Ӱٷ�������߷�Ӧ���ʣ���D��ȷ��
��ѡD��

����Ŀ���ϳɰ������������ͷ�չ������Ҫ���壬1909�������ʵ�������״����õ�����������Ӧ�ϳɰ���ʵ�����˹��̵���
��1����ӦN2(g)+3H2(g)![]() 2NH3(g)�Ļ�ѧƽ�ⳣ������ʽΪ_____��
2NH3(g)�Ļ�ѧƽ�ⳣ������ʽΪ_____��
��2�������������ݷ�������ҵ��ѡ�õ�����������Ӧ�̵�����û��ѡ�õ�����������Ӧ�̵���ԭ����______��
��� | ��ѧ��Ӧ | K(298K)����ֵ |
�� | N2(g)+O2(g) | 5��10-31 |
�� | N2(g)+3H2(g) | 4.1��106 |
��3�����ڷ�ӦN2(g)+3H2(g)![]() 2NH3(g)����һ�������°���ƽ�⺬�����±���
2NH3(g)����һ�������°���ƽ�⺬�����±���
�¶�/�� | ѹǿ/MPa | ����ƽ�⺬�� |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
�ٸ÷�ӦΪ______��������������������������Ӧ��
�ڹ���ѡ�õ�������550�桢10MPa������200�桢10MPa�����ܵ�ԭ����______��
��4��һ���¶��£����ݻ��㶨���ܱ������г���1mol������3mol������һ��ʱ���ﻯѧƽ��״̬�������������������䣬������ƽ����ϵ���ٳ���1mol������3mol������������ƽ��ת����______���������������С����������������
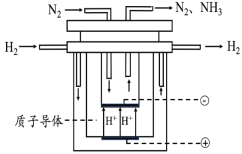
��5�����ܹ����ĺϳɰ�������Ϊ��20���Ϳ�ѧ��������Ի͵ijɾ���֮һ�����Դ��ں��ܸߡ����ʵ͵����⡣��ˣ���ѧ���ڳ���̽����Ѱ��ϳɰ�����·������ͼΪ��ⷨ�ϳɰ���ԭ��ʾ��ͼ�������ĵ缫��ӦʽΪ______��