题目内容
【题目】书写下列反应方程式并回答相关问题,能写离子反应的书写离子反应方程式。
(1)工业上合成氨气_____
(2)铜和稀硝酸__________ 其中硝酸的作用为_____
(3)氨气的催化氧化_____,其中氧化剂与还原剂物质的量之比为_____
(4)用离子反应表示如何检验NH4+___________________
【答案】 N2 + 3H2 ![]() 2NH3 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O 氧化剂 4NH3+5O2
2NH3 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O 氧化剂 4NH3+5O2![]() 4NO+6H2O 5:4 NH4+ + OH-
4NO+6H2O 5:4 NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
【解析】(1)合成氨的反应为氮气和氢气在高温高压、催化剂的条件下的可逆反应:N2 + 3H2 ![]() 2NH3。
2NH3。
(2)铜和稀硝酸反应得到NO,方程式为:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O。硝酸的作用是表现酸性和强氧化性。
(3)氨气的催化氧化反应为:4NH3+5O2![]() 4NO+6H2O,反应中有5个氧气被还原,4个氨气被氧化,所以氧化剂与还原剂物质的量之比为5:4。
4NO+6H2O,反应中有5个氧气被还原,4个氨气被氧化,所以氧化剂与还原剂物质的量之比为5:4。
(4)检验铵根离子的方法为加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验气体。所以反应为:NH4+ + OH- ![]() NH3↑+ H2O。
NH3↑+ H2O。

 名校课堂系列答案
名校课堂系列答案【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
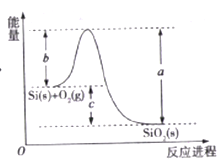
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
【题目】硼镁泥是一种工业废料,主要成分是MgO( 占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2 等杂质,以此为原料制取的硫酸镁,可用于印染、选纸、医药等工业。从硼镁泥中提取MgSO4·7H2O 的流程如下:

根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为______。
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2+ +ClO-+H2O=MnO2 ↓+2H++Cl-,还有一种离子也会被NaClO 氧化,该反应的离子方程式为____________________。
(3)滤渣中除含有Fe(OH)3、A(OH)3 外还有_________________。
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:_________。
(5)已知MeSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4 除去,根据上表数据,简要说明操作步骤: _________。“操怍I:是将滤液继续蒸发依缩,冷却结晶,______,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为_____________________。