题目内容
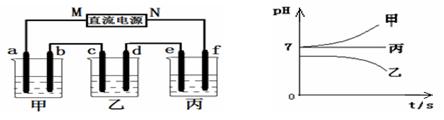
有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质,分别设计了如图所示的原电池,请完成下列问题:
(1)①负极材料:
A池________,B池________。
②电极反应式:
A池:正极:________,负极:________
B池:正极:________,负极:________
(2)B池总反应的离子方程式为_________________________________。
(1)①Mg Al ②2H++2e-=H2↑ Mg-2e-=Mg2+ 6H2O+6e-=6OH-+3H2↑ 2Al+8OH--6e-=2AlO2—+4H2O
(2)2Al+2OH-+2H2O=2AlO2—+3H2↑
解析

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
如下图所示,用铅蓄电池电解100 g 10.0%的硫酸钠溶液,经过一段时间后,测得溶液质量变为95.5 g。下列说法正确的是( )
| A.电路中转移0.25 mol电子 |
| B.铅蓄电池中消耗0.5 mol H2SO4 |
| C.铅蓄电池的负极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO |
| D.Fe电极发生的电极反应为Fe-2e-=Fe2+ |