题目内容
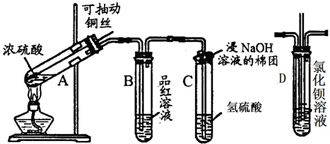
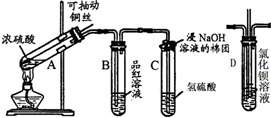
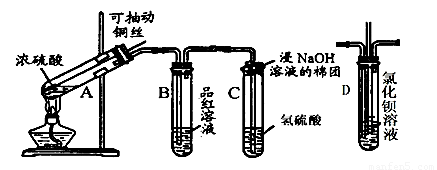
(12分)下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
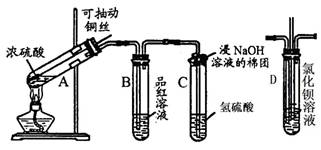
(1)A中发生的反应方程式: 。
(2)试管C口部的棉团上发生反应的离子方程式是 。
(3)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到 。试管C中溶液变浑浊,则证明SO2具有 性。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入Cl2气体,现象
(5)如果反应过程中要立即停止反应,最简单的方法是 。
(12分)(1)Cu+2H2SO4(浓)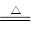 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)SO2+2OH- == SO32-+2H2O
(3)无色变红色;氧化性。(4) 白色沉淀 (5)抽出铜丝到液面上。
【解析】
试题分析:(1)在加热的条件下,铜和浓硫酸反应,反应的方程式是
Cu+2H2SO4(浓)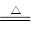 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)SO2属于大气污染物,所以需要尾气处理,因此和氢氧化钠溶液反应的离子方程式是SO2+2OH- == SO32-+2H2O。
(3)SO2能使品红溶液褪色,但这种漂白是不稳定的,加热时又恢复到红色。试管C中溶S液变浑浊,则C中有单质S生成,这说明SO2具有氧化性,能把H2S氧化生成单质S。
(4)氯气具有氧化性,能把SO2氧化生成硫酸,进而生成硫酸钡白色沉淀。
(5)由于A中的铜丝是可以抽动的,所以如果反应过程中要立即停止反应,最简单的方法是抽出铜丝到液面上。
考点:考查浓硫酸的性质、SO2的性质以及实验操作等
点评:该题通过SO2的制备、性质检验、实验操作等,重点考查学生实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。

 阅读快车系列答案
阅读快车系列答案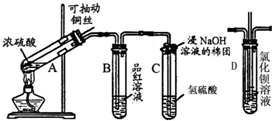 下列是与硫元素相关的一系列实验,根据图所示实验回答下列问题:
下列是与硫元素相关的一系列实验,根据图所示实验回答下列问题: