题目内容
(1)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子最外层电子数是次外层电子数的2倍。D元素是地壳里含量最多的元素。D与E的质子数之和为24。F的最高价氧化物的水化物为最强酸。
①推断E在元素周期表中的位置:第_______周期,_______族。
②A2D的沸点比A2E高的原因是_____________________________________________。
③E、F的最高价氧化物对应水化物的酸性(或碱性)的相对强弱_______,等物质的量浓度的上述两物质的水溶液相应的性质______________。
④在101kPa时,1.4gBD气体在1.6gD2气体中完全燃烧,生成BD2气体时放出14.15kJ
热量,表示BD燃烧热的热化学方程式为:___________________________________。
①推断E在元素周期表中的位置:第_______周期,_______族。
②A2D的沸点比A2E高的原因是_____________________________________________。
③E、F的最高价氧化物对应水化物的酸性(或碱性)的相对强弱_______,等物质的量浓度的上述两物质的水溶液相应的性质______________。
④在101kPa时,1.4gBD气体在1.6gD2气体中完全燃烧,生成BD2气体时放出14.15kJ
热量,表示BD燃烧热的热化学方程式为:___________________________________。
(每小题2分)(1)三、ⅥA (2)H2O与H2O分子之间在氢键作用
(3)酸性HClO4>H2SO4、溶液酸性H2SO4>HClO4。
(4)CO(g)+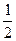 O2(g)=CO2(g);△H=-283kJ/mol
O2(g)=CO2(g);△H=-283kJ/mol
(3)酸性HClO4>H2SO4、溶液酸性H2SO4>HClO4。
(4)CO(g)+
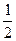 O2(g)=CO2(g);△H=-283kJ/mol
O2(g)=CO2(g);△H=-283kJ/mol易知A是氢、B是碳、D是氧,再推出E是硫,F是氯,C介于B、D之间,故C是氮。水沸点至所以比H2S是因为水分子间能形成氢键,高氯酸是最强的无机含氧酸,但溶液的酸性强弱是由氢离子浓度的大小决定,c(H+)越大,酸性越强。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
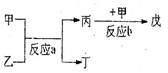
 (3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属
(3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属