题目内容
把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)?H2(g)+I2(g).在反应趋向平衡状态过程中,下列说法正确的是( )
分析:反应物逐渐减少生成物逐渐增多直到达到化学平衡状态,当达到平衡时,正逆反应速率相等.
解答:解:A、HI的生成速率等于其分解速率时是平衡状态,故A错误;
B、HI的生成速率小于其分解速率,则反应逆向进行,是达到平衡后向左移动了,故B错误;
C、HI的生成速率大于其分解速率时,反应正向进行,趋向化学反应限度(平衡状态),故C正确;
D、开始阶段是反应物减少,生成物增加,直到反应达到平衡状态的过程,故D错误.
故选C.
B、HI的生成速率小于其分解速率,则反应逆向进行,是达到平衡后向左移动了,故B错误;
C、HI的生成速率大于其分解速率时,反应正向进行,趋向化学反应限度(平衡状态),故C正确;
D、开始阶段是反应物减少,生成物增加,直到反应达到平衡状态的过程,故D错误.
故选C.
点评:本题考查学生化学平衡状态的建立过程,属于教材知识的考查,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g) 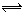 H2(g) +I2(g). 在反应趋向平衡状态过程中,下列说法正确的是 ( )
H2(g) +I2(g). 在反应趋向平衡状态过程中,下列说法正确的是 ( )
| A.HI的分解速率小于其生成速率 | B.HI的分解速率等于其生成速率 |
| C.HI的分解速率大于其生成速率 | D.无法判断 |
 H2(g)+I2(g),在反应趋向化学反应限度的过程中,下列说法正确的是( )
H2(g)+I2(g),在反应趋向化学反应限度的过程中,下列说法正确的是( )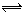 H2(g) +I2(g).
在
H2(g) +I2(g).
在