题目内容
14.下列关于物质性质变化的比较,不正确的是( )| A. | 沸点:F2>Cl2 | B. | 原子半径:Na>Al | ||
| C. | 酸性:HClO4>HBrO4 | D. | 碱性:82Pb(OH)4>50Sn(OH)4 |
分析 A.都为分子晶体,可根据相对分子质量大小判断;
B.同主族元素从上到下,原子半径逐渐增大,同周期元素从左到右,原子半径逐渐减小;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.同主簇元素从上到下金属性逐渐增强,元素金属性越强,最高价氧化物的水化物碱性越强.
解答 解:A.对应的晶体类型都为分子晶体,分子的相对分子质量越大,分子间作用力越强,则单质的熔沸点越高,应为F2<Cl2,故A错误;
B.同主族元素从上到下,原子半径逐渐增大,同周期元素从左到右,原子半径逐渐减小,则原子半径Na>Al,故B正确;
C.元素非金属性Cl>Br,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D.同主簇元素从上到下金属性逐渐增强,则有金属性强弱:82Pb>50Sn,元素金属性越强,最高价氧化物的水化物碱性越强,所以82Pb(OH)4>50Sn(OH)4,故D正确.
故选A.
点评 本题考查元素周期律的递变规律,题目难度不大,注意把握元素的递变规律以及与对应单质、化合物的性质的关系以及比较角度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列关于胶体的说法正确的是( )
| A. | 胶体的分散质粒子能通过滤纸,而其他分散系的分散质粒子不能通过滤纸 | |
| B. | 氢氧化铁胶体、硫酸铜溶液用激光笔照射,均能观察到一条光亮的通道 | |
| C. | 胶体区分于溶液的本质特征是胶体的分散质粒子直径在1nm~100nm之间 | |
| D. | 氢氧化铝和氢氧化铁胶体可用于净水是因为它们具有强氧化性 |
2.设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17gNH3所含电子数目为10NA | D. | 18g水所含分子数目为NA |
9.下列说法正确的是( )
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2均是非电解质,所以NH3、CO2的水溶液均不能导电 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
19.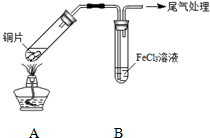 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
FeCl3溶液显酸性的原因是Fe3++3H2O?Fe(OH)3+3H+.写出装置A中产生SO2的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为生成蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA个 | |
| B. | 1mol/L 的MgCl2溶液中,含有Cl-个数为2NA个 | |
| C. | 室温时,1 NA个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA个 |
