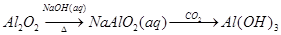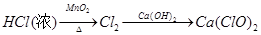题目内容
以下进行性质比较的实验,不合理的是
| A.比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液 |
| B.比较氯、溴非金属性:溴化钠溶液中通入氯气 |
| C.比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
C
试题分析:A.比较镁、铝金属性的强弱可以通过它们的最高价氧化物对应的水化物的碱性的强弱。即氯化镁、氯化铝溶液中分别加入过量的NaOH溶液。Mg(OH)2不能与过量的NaOH溶液反应,而AlCl3溶液中加入少量的NaOH溶液产生白色Al(OH)3沉淀,当碱过量时沉淀也溶解消失。说明Al(OH)3呈两性。从而证明了金属性镁>铝。正确。B.比较元素非金属性的强弱可以通过单质之间的置换反应来证明。活动性强的能把活动性弱的非金属置换出来。溴化钠溶液中通入氯气发生反应:Cl2+2NaBr=2NaCl+Br2 。非金属性:Cl>Br.C.铁加入硫酸铜溶液中发生反应:Fe+CuSO4=FeSO4+Cu.只能证明还原性Fe>Cu. 而不能证明Cu、Fe2+的还原性的强弱。错误。D. 高锰酸钾中加入浓盐酸发生反应:2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O。氧化性:氧化剂KMnO4>氧化产物 Cl2。因此可以比较高锰酸钾、氯气的氧化性的强弱。正确。

练习册系列答案
相关题目