题目内容
 (2011?福建模拟)甲是一元强碱,其阴、阳离子所含电子总数相等.在溶液中能发生下列反应:
(2011?福建模拟)甲是一元强碱,其阴、阳离子所含电子总数相等.在溶液中能发生下列反应:甲+乙
| △ |
Ⅰ.若丙是NH3.
(1)甲与乙溶液反应的离子方程式是
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
(2)820℃时,一定量NH3和O2反应生成NO和H2O,反应达到化学平衡.平衡常数K=
| c4(NO)×c6(H2O) |
| c4(NH3)×c5(O2) |
| c4(NO)×c6(H2O) |
| c4(NH3)×c5(O2) |
N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
.Ⅱ.若乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,X2-的结构示意图为
(3)丙溶液中,c (OH-)
>
>
c (HX-)(填“>”、“<”或“=”);丁的化学式为Na2SO3
Na2SO3
.(4)元素Y与X同主族且位置相邻,H2X(g)、H2Y(g)各1mol发生分解反应(产物除氢气外,另一种物质的状态相同)的反应热分别为+20.6kJ?mol-1、-29.7kJ?mol-1.Y在周期表中的位置是
第4周期ⅥA族
第4周期ⅥA族
.分析:Ⅰ.甲是一元强碱,其阴、阳离子所含电子总数相等,则甲为NaOH,甲+乙
丙+丁+水,若丙为氨气,则乙为铵盐,
(1)氢氧根离子与铵根离子在加热时反应生成氨气和水;
(2)根据反应4NH3+5O2═4NO+6H2O及平衡常数为生成物浓度幂之积与反应物浓度幂之积的比来分析;利用能量变化图及盖斯定律来书写N2与O2反应生成NO的热化学方程式;
Ⅱ.X2-的结构示意图为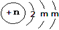 ,则m为8,n=18-2=16,即X为S,乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,则
,则m为8,n=18-2=16,即X为S,乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,则
丙为Na2S,丁为Na2SO3,
(3)由水解来分析离子浓度的关系,及氧化还原反应分析丁;
(4)元素Y与X同主族且位置相邻,则Y为Se或O,由反应热分析元素的非金属性,以此来确定位置.
| △ |
(1)氢氧根离子与铵根离子在加热时反应生成氨气和水;
(2)根据反应4NH3+5O2═4NO+6H2O及平衡常数为生成物浓度幂之积与反应物浓度幂之积的比来分析;利用能量变化图及盖斯定律来书写N2与O2反应生成NO的热化学方程式;
Ⅱ.X2-的结构示意图为
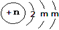 ,则m为8,n=18-2=16,即X为S,乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,则
,则m为8,n=18-2=16,即X为S,乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,则丙为Na2S,丁为Na2SO3,
(3)由水解来分析离子浓度的关系,及氧化还原反应分析丁;
(4)元素Y与X同主族且位置相邻,则Y为Se或O,由反应热分析元素的非金属性,以此来确定位置.
解答:解:Ⅰ.甲是一元强碱,其阴、阳离子所含电子总数相等,则甲为NaOH,甲+乙
丙+丁+水,若丙为氨气,则乙为铵盐,
(1)氢氧根离子与铵根离子在加热时反应生成氨气和水,该离子反应为NH4++OH-
NH3↑+H2O,故答案为:NH4++OH-
NH3↑+H2O;
(2)因反应为4NH3+5O2═4NO+6H2O,则K=
,
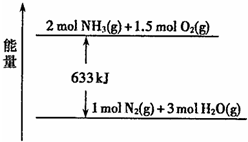
该反应的热化学方程式为4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906kJ/mol①,
由图可知,2NH3(g)+
O2(g)═N2 (g)+3H2O(l)△H=-633kJ/mol②,
由盖斯定律可知,
可得N2 (g)+O2 (g)=2NO(g)△H=+180 kJ?mol-1,
故答案为:c4(NO)×c6(H2O)/c4(NH3)×c5(O2);N2 (g)+O2 (g)=2NO(g)△H=+180 kJ?mol-1;
Ⅱ.X2-的结构示意图为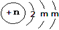 ,则m为8,n=18-2=16,即X为S,乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,则
,则m为8,n=18-2=16,即X为S,乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,则
丙为Na2S,丁为Na2SO3,
(3)因S2-的水解分两步进行,水解显碱性,则离子浓度c (OH-)>c (HS-),由氧化还原反应,硫元素的化合价由0降低为-2价,则丁中S元素的化合价为+4价,即丁为Na2SO3,
故答案为:>;Na2SO3;
(4)元素Y与X同主族且位置相邻,则Y为Se或O,H2X(g)、H2Y(g)各1mol发生分解反应(产物除氢气外,另一种物质的状态相同)的反应热分别为+20.6kJ?mol-1、-29.7kJ?mol-1,则X的非金属性强,即Y为Se,在元素周期表中的第4周期ⅥA族,故答案为:第4周期ⅥA族.
| △ |
(1)氢氧根离子与铵根离子在加热时反应生成氨气和水,该离子反应为NH4++OH-
| ||
| ||
(2)因反应为4NH3+5O2═4NO+6H2O,则K=
| c4(NO)×c6(H2O) |
| c4(NH3)×c5(O2) |
该反应的热化学方程式为4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906kJ/mol①,
由图可知,2NH3(g)+
| 3 |
| 2 |
由盖斯定律可知,
| ①-②×2 |
| 2 |
故答案为:c4(NO)×c6(H2O)/c4(NH3)×c5(O2);N2 (g)+O2 (g)=2NO(g)△H=+180 kJ?mol-1;
Ⅱ.X2-的结构示意图为
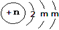 ,则m为8,n=18-2=16,即X为S,乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,则
,则m为8,n=18-2=16,即X为S,乙是由元素X组成的单质,丙、丁都是正盐,且均能使酸性KMnO4溶液褪色.丙中所含阴离子为X2-,则丙为Na2S,丁为Na2SO3,
(3)因S2-的水解分两步进行,水解显碱性,则离子浓度c (OH-)>c (HS-),由氧化还原反应,硫元素的化合价由0降低为-2价,则丁中S元素的化合价为+4价,即丁为Na2SO3,
故答案为:>;Na2SO3;
(4)元素Y与X同主族且位置相邻,则Y为Se或O,H2X(g)、H2Y(g)各1mol发生分解反应(产物除氢气外,另一种物质的状态相同)的反应热分别为+20.6kJ?mol-1、-29.7kJ?mol-1,则X的非金属性强,即Y为Se,在元素周期表中的第4周期ⅥA族,故答案为:第4周期ⅥA族.
点评:本题考查知识点较多,注重对离子反应、热化学反应方程式、水解、非金属性比价等考查热点的训练,难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
 (2011?福建模拟)美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是( )
(2011?福建模拟)美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是( ) (2011?福建模拟)某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是( )
(2011?福建模拟)某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是( )