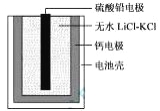
题目内容
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2 (g) +3H2 (g)![]() 2NH3 (g)△H = - 92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3 (g)△H = - 92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:

下列叙述正确的是( )
A.放出热量关系:a<b<92.4 B.放出热量关系:b<a< 92.4
C.平衡时氨气的体积分数:①>③ D.N2的转化率:②>①>③
【答案】A
【解析】
试题分析:A.N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol。焓变是指1mol氮气和3mol氢气全部反应放出的热量;①由于该反应是可逆反应,反应物不能完全转化为生成物,所以起始量反应不能全部转化,因此a<92.4kJ,②起始量相当于在①中加入了1mol氮气,加入反应物的浓度,化学平衡正向移动,所以平衡正向进行反应放出的热量b>a,但是反应是可逆反应不能进行彻底所以b<92.4kJ,故放出热量关系:a<b<92.4,A正确;B.根据A中分析可知B错误;C.③相当于在体积是①的2倍的容器中压缩容器的容积,增大压强,化学平衡向气体体积减小的方向移动,所以达到平衡后氨气的体积分数,③>①,C错误;D.②相当于①达到平衡后再加入1mol N2,化学平衡正向移动,但是平衡移动的趋势是微弱的,氮气转化量远小于加入的物质的量,所以氮气的转化率①>②;根据C的分析可知③相当于①平衡后将容器的容积减小至原来的1/2,化学平衡正向移动,氮气的转化率增大,所以③>①,所以氮气转化率③>①>②,D错误。答案选A。
2NH3(g) △H=-92.4 kJ/mol。焓变是指1mol氮气和3mol氢气全部反应放出的热量;①由于该反应是可逆反应,反应物不能完全转化为生成物,所以起始量反应不能全部转化,因此a<92.4kJ,②起始量相当于在①中加入了1mol氮气,加入反应物的浓度,化学平衡正向移动,所以平衡正向进行反应放出的热量b>a,但是反应是可逆反应不能进行彻底所以b<92.4kJ,故放出热量关系:a<b<92.4,A正确;B.根据A中分析可知B错误;C.③相当于在体积是①的2倍的容器中压缩容器的容积,增大压强,化学平衡向气体体积减小的方向移动,所以达到平衡后氨气的体积分数,③>①,C错误;D.②相当于①达到平衡后再加入1mol N2,化学平衡正向移动,但是平衡移动的趋势是微弱的,氮气转化量远小于加入的物质的量,所以氮气的转化率①>②;根据C的分析可知③相当于①平衡后将容器的容积减小至原来的1/2,化学平衡正向移动,氮气的转化率增大,所以③>①,所以氮气转化率③>①>②,D错误。答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目